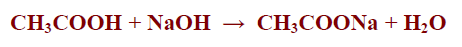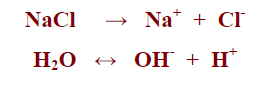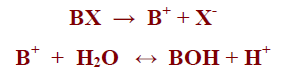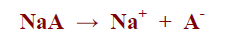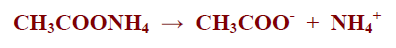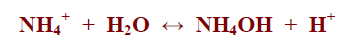تأين الأملاح Disassociation of salts واشتقاق قوانين pH
– وفي هذا الموضوع سيتم مناقشة عن الاتزان في الأملاح (تأين الأملاح) وكيفية اشتقاق قوانين pH للأملاح الناتجة من حمض قوي وقاعدة قوية، أو الناتجة من حمض ضعيف وقاعدة ضعيفة، أو الناتجة من حمض قوي وقاعدة ضعيفة، أو الناتجة من قاعدة قوية وحمض ضعيف. ولكن قبل بداية الموضوع دعونا نعطي نبذة تعريفية عن الأملاح.
محتويات الموضوع
تعريف الأملاح Salts
– يعرف الملح بأنه المادة المشتقة من حمض وقاعدة.
– ولما كان هناك أحماض وقواعد قوية، وكذلك أحماض وقواعد ضعيفة فإن عملية تكوين الملح ستعتمد على نوع الحمض والقاعدة المتفاعلين لإنتاجه.
– ولهذا فإن للأملاح أربعة أنواع حسب اشتقاقها وهي كما يلي:
أنواع الأملاح Types of Salts
(1) أملاح مشتقة من أحماض قوية وقواعد قوية
– مثل كلوريد الصوديوم الذي ينتج من تفاعل حمض الهيدروكلوريك مع هيدروكسيد الصوديوم كما بالمعادلة التالية:
(2) أملاح مشتقة من أحماض قوية وقواعد ضعيفة
– مثل كلوريد الامونيوم والذي ينتج من تفاعل حمض الهيدروكلوريك مع هيدروكسيد الامونيوم كما بالمعادلة التالية:
(3) أملاح مشتقة من أحماض ضعيفة وقواعد قوية
– مثل خلات الصوديوم والذي ينتج من تفاعل حمض الخليك مع هيدروكسيد الصوديوم كما بالمعادلة التالية:
(4)أملاح مشتقة من أحماض ضعيفة وقواعد ضعيفة
– مثل خلات الامونيوم التي تنتج من تفاعل حمض الخليك مع هيدروكسيد الامونيوم كما بالمعادلة التالية:
(1) تأين الأملاح المشتقة من حمض قوي وقاعدة قوية
– إن التحلل المائي لملح هو تفاعل أحد الشقين أو كلاهما مع الماء.
– على سبيل المثال يتأين كلوريد الصوديوم كما بالمعادلة التالية:
– لا يؤثر هذا النوع من الأملاح على درجة الحموضة لأن النواتج وهي هيدروكسيد الصوديوم وحمض الهيدروكلوريك إلكتروليتات قوية أي أنها ستتأين تأيناً كاملاً.
– كما أن أيونات الكلوريد Cl– وأيونات الصوديوم Na+ حموض وقواعد مقابلة لقواعد وحموض مقترنة، فلا يميل أيون الصوديوم للتفاعل مع الهيدروكسيد الناتج عن تفكك الماء، ولا يميل أيون الكلوريد للتفاعل مع أيون الهيدروجين الناتج كذلك عن تفكك الماء، وبذلك ليس لها أثر على الإتزان. وتكون محاليل هذا الناتج من الأملاح ذات أثر متعادل.
(2) تأين الأملاح المشتقة من حمض قوي وقاعدة ضعيفة
– تعطي محاليل هذه الأملاح زيادة ظاهرة من تركيز أيونات الهيدروجين لأن أيونات الهيدروكسيد ستتفاعل مع الأيونات الموجبة للقاعدة الضعيفة مكونة القاعدة الضعيفة قليلة التفكك.
– بفرض أن لدينا الملح BXوهو ملح شقه القاعدي ضعيف يتأين في الماء كما بالمعادلة التالية:
– بتطبيق قانون فعل الكتلة نجد أن:
Kb = [H+][BOH] / [B+]
– وحيث أن ثابت تأين الماء يعطى كما بالعلاقة الآتية:
Kw = [H+] [OH–]
– وثابت تأين القاعدة هو كما يلي:
Kb = [B+][OH–] / [BOH]
K = [H+][BOH] / [B+] = Kw / Kb
– ويمكن اعتبار أن تركيز الأيونات [B+] = تركيز الملح Cb
– وتركيز الأيون [H+] = تركيزالقاعدة [BOH] وبالتعويض كما يلي:
Kw / Kb = [H+]2 / C
[H+]2 = Kw/Kb . C

pH = 1/2 pKw – 1/2 pKb – 1/2 log Cb
– ويكون القانون الأخير هو قانون pH لتأين الأملاح المشتقة من حمض قوي وقاعدة ضعيفة.
(3) تأين الأملاح المشتقة من حمض ضعيف وقاعدة قوية
– يتأين الملح NaAالمشتق من حمض ضعيف وقاعدة قوية كما بالمعادلة التالية:
– ويتميه الشق الحمضي الضعيف في الماء كما بالمعادلة التالية:
– وبتطبيق قانون فعل الكتلة:
K = [HA][OH–] / [A–]
– وثابت تأين الماء:
Kw = [H+][OH–]
– وثابت تأين الحمض الضعيف:
Ka = [H+][A–] / [HA]
K = [HA][OH–] / [A–] = Kw/Ka
– ويمكن إعتبار أن تركيز أيون [A–] = تركيز الملح C
– وتركيز الحمض = تركيز أيونات الهيدروكسيد [AH] = [OH–]
Kw/Ka = [OH–]2 / C
[OH–]2 = Kw/Ka . C
P[OH–] = 1/2 log Kw + 1/2 log Ka – 1/2 log C
pH = pKw – pOH
pH = 1/2 pKw + 1/2 pKa + 1/2 log C
– ويكون القانون الأخير هو قانون pH لتأين الأملاح المشتقة من حمض ضعيف وقاعدة قوية
(4) تأين الأملاح المشتقة من حمض ضعيف وقاعدة ضعيفة
– تتأين الأملاح المشتقة من حمض ضعيف وقاعدة ضعيفة مثل خلات الامونيوم كما بالمعادلة التالية:
– ويتميه أيون الامونيوم كما بالمعادلة التالية:
K = Kw / Kb = [NH4OH][H+] / [NH4+]
– ويتميه أيون الخلات كما بالمعادلة التالية:
K = Kw / Ka = [CH3COOH][OH–] / [CH3COO–]
– ومن معادلتي ثابت الإتزان نجد أن:
Kw = [NH4OH][H+] / [NH4+]
Kb = [CH3COOH][OH–] / [CH3COO–] Ka
– وبما أن:
[NH4+] = [CH3COO–]
[NH4OH] = [CH3COOH]
إذَا:
[H+] Kb = [OH–] Ka
[OH–] = Kw / [H+]
[H+] Kb = Kw / [H+] . Ka
[H+]2 = Ka / Kb . K
pH = 1/2 pKa + 1/2 pKw – 1/2 pKb
– ويكون القانون الأخير هو قانون pH لتأين الأملاح المشتقة من حمض ضعيف وقاعدة ضعيفة
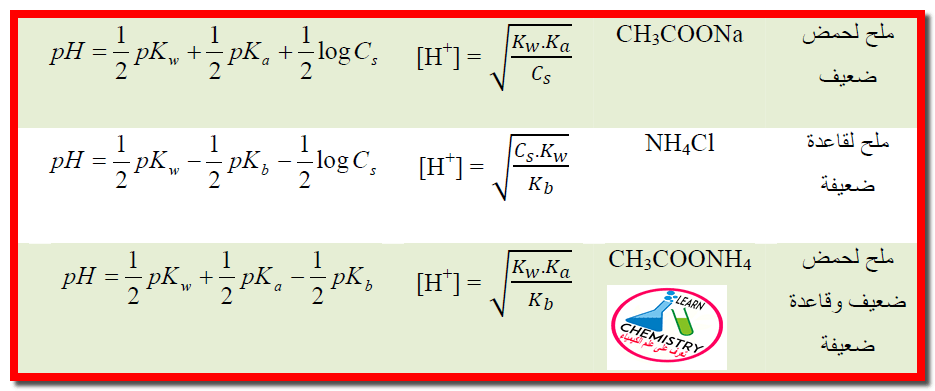
ملخص قوانين pH لتأين الأملاح
– يمكن تلخيص القوانين السابقة في الجدول الآتي كما يلي:
المراجع: محاضرات الكيمياء التحليلية “التحليل الحجمى والوزني CHEM 211” . خيرية محمد عبدالله الأحمري – (1430 – 1429) جامعة الملك عبد العزيز- المملكة العربية السعودية.