برمنجنات البوتاسيوم – الأكسدة بواسطة برمنجنات البوتاسيوم
– برمنجنات البوتاسيوم من أهم العوامل المؤكسدة فى معايرات الأكسدة والأختزال وسيتم مناقشة الأكسدة بواسطة برمنجنات البوتاسيوم في هذا الموضوع بالتفصيل.
محتويات الموضوع
خصائص برمنجنات البوتاسيوم Potassium permanganate
من أهم خصائص برمنجنات البوتاسيوم الخصائص الآتية كما يلي:
– برمنجات البوتاسيوم من أهم العوامل المؤكسدة فى معايرات الأكسدة والأختزال.
– هي مادة صلبة تعطي محلولاً مائياً بنفسجياً يميز هذه المادة.
– كما تعتبر برمنجنـات البوتاسيوم عامل مؤكسد قوي تعمل على وفق الرقم الهيدروجيني pH للوسط التفاعلي.
– تعتبر دليل ذاتي في معايرات الأكسدة والأختزال في المحاليل التي تركيزها أكبر من 0.01N
– لا تعتبر مادة قياسية أولية وذلك للأسباب الآتية كما يلي:
(1) برمنجنات البوتاسيوم الصلبة تحتوي على القليل من ثاني أكسيد المنجنيز الذي يسبب عدم ثبات المحاليل.
(2) تتأثر البرمنجنات بالضوء والحرارة.
الأكسدة باستخدام برمنجنات البرتاسيوم فى الأوساط المختلفة
(1) في الوسط الحامضي
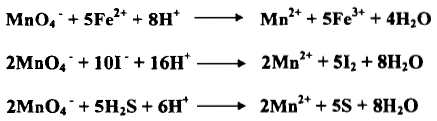
– تعتبر برمنجنات البوتاسيوم عامل مؤكسد قوي حيث تختزل بواسطة 5 إلكترونات كما يلي:
– إذا يتغير عدد تأكسد المنجنيز من +7 إلى +2 وتتحول من اللون البنفسجي إلى عديمة اللون كما هو مبين بالمعادلة السابقة.
– هذه بعض التفاعلات المهمة التي تنجز بواسطة أيونات البرمنجنات في وسط حمضي كما يلي:
(2) في الوسط المتعادل أو القاعدي الضعيف
– في وسط متعادل أو قاعدي ضعيف تعتبر برمنجنات البوتاسيوم عامل مؤكسد ضعيف حيث تختزل البرمنجنات إلى ثاني أكسيد المنجنيز إذ يتغير عدد التأكسد للمنجنيز من +7 إلى +4 وتتحول من اللون البنفسجي إلى اللون الأسود.
– وكمثال على هذا تأكسد المنجنيز الثنائي كما يلي:
– ونظراً لتكوين أيون الـ H+ فقد ينعكس التفاعل لذا يجب استعمال محلول منظم buffer solution يستعمل هذا التفاعل في معايرة المنجنيز وتعيينه كمياً إذ يستعمل أكسيد الزنك ZnO بوصفه منظماً.
(3) في الوسط القاعدي القوى
– في وسط قاعدي قوى (pH = 13) أو أكثر تعتبر برمنجنات البوتاسيوم عامل مؤكسد ضعيف جداً حيث تختزل البرمنجنـات إلى أيون البرمنجنـات بفقدان إلكترون واحد كما يلي:
– إذ يكون عدد التأكسد للمنجنيز +6 وتظهر البرمنجنات لوناً اخضراً مميزاً. فعندما تسخن البرمنجنات مع القلويات يحدث التفاعل الاختزالي وينطلق الأكسجين:
– لوجود الأسباب من (4) إلى (7) يستخدم حمض الكبريتيك في تفاعلات الأكسدة والاختزال ببرمنجنـات البوتاسيوم في الوسط الحمضي ولا يستخدم حمض الهيدروكلوريك.
عيوب الأكسدة باستخدام برمنجنات البوتاسيوم
– لمحاليل البرمنجنات عيوب عديدة منها العيوب الآتية كما يلي:
(1) تؤكسد أيون الكلوريد (–Cl) وبالتالي لا نستطيع استخدام حمض HCl كوسط حمضي كما يلي:
(2) تؤكسد الماء وتحرر غاز الأكسجين وبالتالي فان محاليلها غير ثابتة.
(3) تتأثر بالضوء ولهذا تحفظ في زجاجات بنية بعيدا عن الضوء.
تطبيقات المعايرات بواسطة برمنجنات البوتاسيوم
تستخدم برمنجنـات البوتاسيوم في تقدير الكثير من المواد ومن أهم هذه التطبيقات كما يلي:
(1) تقدير الحديد في خاماته
– تستخدم برمنجنات البوتاسيوم لتقدير الحديد الثنائي لأكسدته بواسطة برمنجنـات البوتاسيـوم إلى الحديد الثلاثي ويتم إتباع الخطوات الآتية كما يلي:
(1) إذابة العينة باستخدام حمض الهيدروكلوريك.
(2) اختزال الحديد الثلاثي في العينة إلى الحديد الثنائي قبل المعايرة باستخدام كلوريد القصديروز SnCl2 ويجب التخلص من كلوريد القصديروز الزائد لتفاعله مع البرمنجنات وذلك بإضافة كلوريد الزئبقيك الذي لا يتفاعل مع البرمنجنات.
(3) عند معايرة الحديد في وجود حمض الهيدروكلوريك الذي يستخدم لإذابة العينة فيجب إستخدام كاشف زمرمان الذي يتكون من المركبات الآتية كما يلي:
- كبريتات المنجنيز MnSO4 ويستخدم لحماية الكلوريد من الأكسدة
- حمض الفوسفوريك H3PO4 ويستخدم لتحويل الحديد الثلاثي إلى مركب عديم اللون.
- حمض الكبريتيك اللازم لمعايرات برمنجنـات البوتاسيوم في الوسط الحامضي
(2) تقدير الكالسيوم
– يقدر الكالسيوم بطريقة غير مباشرة حيث يرسب الكالسيوم على هيئة أوكسالات الكالسيوم التي عند إذابتها في حمض الكبريتيك يتكون حمض الأكساليك الذي يعاير بواسطة برمنجنات البوتاسيوم.
المراجع:
- كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي) / محمد مجدي عبد الله واصل جامعة الأزهر الشريف / دار الفجر للنشر والتوزيع / القاهرة
- محاضرات الكيمياء التحليلية (التحليل الحجمى والوزني) / خيرية محمد عبدالله الأحمري /(1430 – 1429 هـ ) / جامعة الملك عبد العزيز- المملكة العربية السعودية.