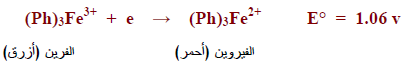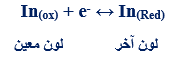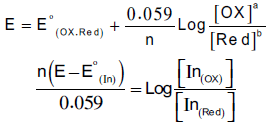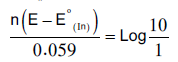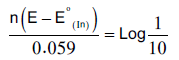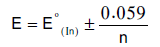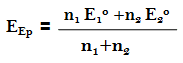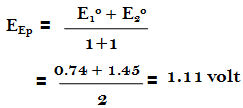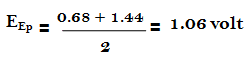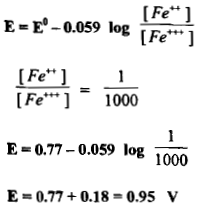أنواع الأدلة المستخدمة في معايرات الأكسدة والاختزال
محتويات الموضوع
أنواع الأدلة المستخدمة في معايرات الأكسدة والاختزال
– في هذا الموضوع سيتم مناقشة أنواع الأدلة المستخدمة في معايرات الأكسدة والاختزال Indicators for Redox Titration وهي كما يلي:
(1) الأدلة الذاتية Self-Indicators
(2) الأدلة الخاصة (النوعية) Specific Indicators
(3) الأدلة الخارجية External Indicators
(4) أدلة الأكسدة والاختزال الحقيقة True Redox Indicators
– وسنتناول كل نوع من أنواع الأدلة المستخدمة في معايرات الأكسدة والاختزال وأمثلة عليها بالتفصيل كما يلي:
(1) الأدلة الذاتية Self-Indicators
– الأدلة الذاتية هي عبارة عن مواد أكسدة أو اختزال یتغیر لونها عند نقطة التكافؤ وهذه المواد تعد نفسها دلیلاً.
– من أمثلة الأدلة الذاتية: برمنجانات البوتاسيوم ((KMnO4
– تعد برمنجانات البوتاسيوم ((KMnO4 كعامل مؤكسد ودليلاً ذاتياً في نفس الوقت، حیث یزول لون البرمنجنات عند المعایرة وقبل نقطة التكافؤ وذلك نتیجة اختزالها إلى أيون المنجنيز الثنائي (MnO2) ولكن بإضافة قطرة زائدة بعد نقطة التكافؤ یتلون المحلول بلوناً قرمزياً واضحاً (وردي خفیف).
– من عيوب هذه الطريقة وجود كمية زائدة من المادة المؤكسدة عند نهاية التسحيح.
(2) الأدلة الخاصة (النوعية) Specific Indicators
– الأدلة النوعية وهي عبارة عن مواد تتفاعل مع إحدى المواد الداخلة في التفاعل أو الناتجة عنه دون أن تتفاعل مع المواد الأخرى لتعطي لوناً مميزاً.
– من أمثلة الأدلة النوعية: دليل النشا – أيون الثايوسيانات (SCN–)
– دليل النشا الذي يستخدم في معايرات اليود حيث يكون مع اليود معقد أزرق داكن. ویختفي اللون باختفاء الیود ویعود اللون بعودة الیود.
– أيون الثايوسيانات (SCN–) كدلیل خاص في معایرة الحدید الثلاثي (الحدیدیك) حیث یكون الثایوسیانات مركباً معقداً أحمر اللون مع الحدید الثلاثي (III) ویختفي اللون بزيادة الحدید الثلاثي نتیجة لاختزاله إلى الحدید الثنائي (II).
(3) الأدلة الخارجية External Indicators
– لا يضاف الدليل من هذا النوع إلى العينة بل يؤخذ جزء من المحلول للكشف عن نقطة التكافؤ.
– حيث تستعمل هذه الدلائل فيما يسمى بالاختبار النقطي Spot test وذلك عندما لا يتوفر دليل داخلي Internal indicator
– من أمثلة الأدلة الخارجية: حديدي سيانيد البوتاسيوم K3[Fe(CN)6]
– يستخدم حديدي سيانيد البوتاسيوم K3[Fe(CN)6] كدليل عند معايرة الحديد الثنائي مع ثاني كرومات البوتاسيوم حيث يعطي لون أزرق مع أيون الحديد الثنائي على صفيحة أختبار Spot plate خارج إناء التسحيح.
– ليس للأدلة الخارجية فائدة كبيرة في التحليل نظراً لأن الخطأ الناتج عن نقل جزء من المحلول إلى الخارج لتحديد نقطة التكافؤ سيكون في هذه الحالة كبيراً.
– ولهذا لا تستخدم هذه الأدلة إلا في حالة عدم توفر أدلة أخرى.
(4) أدلة الأكسدة والاختزال الحقيقة True Redox Indicators
– وهي عبارة عن مركبات عضویة او حوامض ضعيفة تخضع للأكسدة والأختزال ويكون لها لونان مختلفان.
– حيث يكون لها لون خاص في حالة التأكسد ولون آخر في حالة الاختزال كما هو الحال في دلائل التعادل.
– یتغیر لون الدلیل تبعاً لتغیر الجهد في النظام.
– من أمثلة هذه الأدلة: دلیل معقد ( 10.1 فینانترولین الحدیدوز)
– يعطي دلیل معقد ( 10.1 فینانترولین الحدیدوز) مع الحديد الثنائي متراكب يعرف بالفيروين وله لون أحمر في حين أن متراكبه مع الحديد الثلاثي يسمى الفرين ولونه أزرق ويختزل هذا المتراكب إلى الفيروين حسب المعادلة الآتية كما يلي:
– يرمز لهذا الدلائل بصفة عامة بالرمز (In) وتمثل بوصفها مجموعة تأكسدية اختزالية كما يلي:
– وبتطبيق معادلة نيرنست كما يلي:
– من ترتيب المعادلة السابقة يتبين أن نسبة تركيب اللونين يتغير بتغير الجهد.
– ومن المعلوم أن العين البشرية لا تميز لونين في مزيج إلا إذا كان أحدهما عشرة أضعاف الآخر فعند تعويض هذه النسبة او مقلوبها في المعادلة السابقة نحصل المعادلات الآتية كما يلي:
أو
– ومن المعادلتين السابقتين نجد أن:
– أي أن مدى عمل الدليل يقع بين:
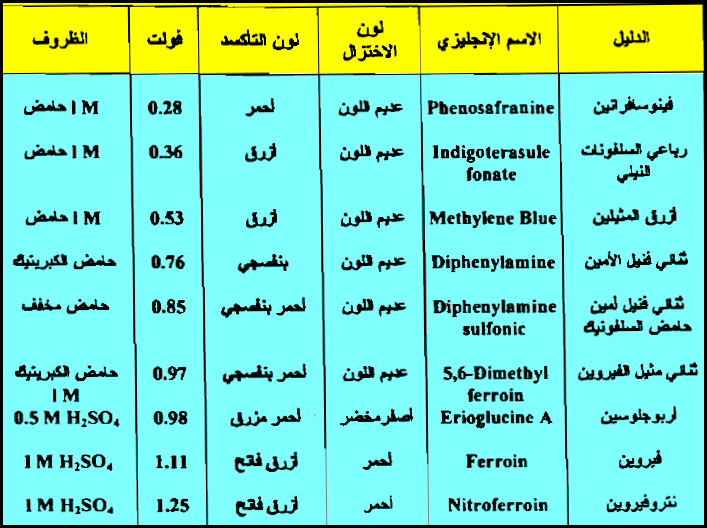
قائمة بأهم الأدلة المستخدمة في معايرات الأكسدة والاختزال
– الجدول التالي يوضح قائمة بأهم الأدلة المستخدمة في معايرات الأكسدة والاختزال كما يلي:
كيفية اختيار الدليل المناسب
– لغرض اختیار الدلیل المناسب لأي عملیة معایرة تأكسد – اختزال لابد من توفر شرطین كما يلي:
(1) معرفة جهد القطب الدلیل القیاسي (EoIn)
(2) معرفة جهد التفاعل (E) عند نقطة التكافؤ
– من الواضح أن الدليل يجب أن يغير لونه عند أو قرب جهد نقطة التكافؤ Equivalence Potential فإذا كان التسحيح ملائماً فإنه يعطي تبدلاً حاداً في الجهد عند نقطة التكافؤ وهذا يجب أن يكون كافياً ليؤدي إلى تغير لون الدليل.
– أن المثالين الآتيين يوضحان الأسلوب الذي يجب إتباعه لاختيار الدليل المناسب.
مسائل محلولة على أنواع الأدلة فى معايرات الأاكسدة والاختزال
مثال (1): أى دليل يجب أن ينتقى لتسحيح الحديد بمحلول كبريتات السيريوم؟
– إن جهد نقطة التكافؤ لهذ التفاعل هي 1.19 فولت ( وذلك من المنحنى العياري).
Ce4+ + Fe2+ ………. Ce3+ + Fe3+
– إذ أن الجهد عند نقطة التكافؤ تكون كما يلي:
– إذ أن ( n1 ، n2 عدد الالكترونات لكل حالة) ويساوي كل منها إلى واحد.
– وعلى وفق ذلك يجب أن نعود إلى جدول الدلائل التأكسدية الأختزالية السابق ونختار الدليل الذي له جهد انتقالي يقرب من هذه القيمة ومنه نجد أن الجهد الانتقالي للفيريون هو المناسب والحقيقة أن الفيريون ذو الجهد الانتقالي 1.11 فولت يستعمل عادة لمثل هذا التسحيح.
– تجرى هذه المعايرة عادة فى محيط من حمض الكبريتيك وأن جهد المنظومة يمكن حسابه باستعمال الجهود الفورمالية ولذا فإنه عند نقطة التكافؤ في مثل هذه الظروف كما يلي:
– وهكذا فإن الجهد الانتقالي للفيريون أقرب إلي هذه القيمة من النيتروفيريون. إن الجهد القياسي للفيريون هو 1.06 فولت ولكن التبدل اللوني له يحدث عند 1.11 فولت.
مثال (2): ما قيمة الجهد الانتقالي لدليل يبدل لونه عند تأكسد كل أيون الحديدوز عدا 0.1% إلى أيون الحديديك؟
– يمكن حساب قيمة الجهد الانتقالي من المعادلة الآتية كما يلي:
– أن هذه القيمة للجهد الانتقالي تتفق مع قيم الجهود الواقعة قرب نقطة التكافؤ في منحنى تسحيح الحديد مع السيريوم والتي يكون عندها حوالي 99.9 من الحديدوز وقد تأكسد وفي هذه الحالة يكون الخطأ العياري مهملاً.
المراجع:
- كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي) / محمد مجدي عبد الله واصل جامعة الأزهر الشريف / دار الفجر للنشر والتوزيع / القاهرة
- كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها
- محاضرات الكيمياء التحليلية (التحليل الحجمى والوزني) / خيرية محمد عبدالله الأحمري /(1430 – 1429 هـ ) / جامعة الملك عبد العزيز- المملكة العربية السعودية.