العيارية Normality + مسائل محلولة

العيارية Normality
العيارية ھي عدد الأوزان المكافئة الجرامیة (Eq) من المادة المذابة الموجودة في لتر من المحلول (Vsol) . يصاغ هذا القانون رياضياً كما يلي :

كيفية حساب عدد المكافئات الجرامية (Eq)
أمثلة توضيحية:
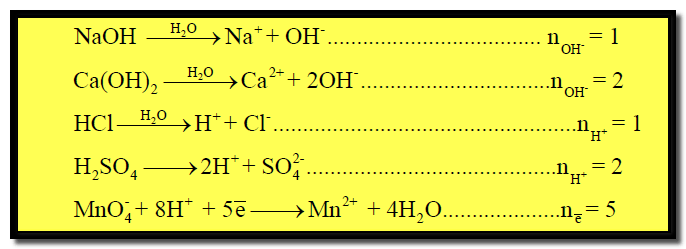
(1) مول واحد من حمض الكبريتيك H2SO4 يحتوي على مولين (2 moles) من أيونات الهيدروجين (H+).
(2) مول واحد من قاعدة هيدروكسيد الصوديوم NaOH يحتوي مولاً واحداً من أيونات الهيدروكسيد (OH–)
(3) مول واحد من هيدروكسيد الكالسيوم Ca(OH)2 يحتوى على مولين من أيونات الهيدروكسيد.
والأمثلة التالية توضح ذلك :
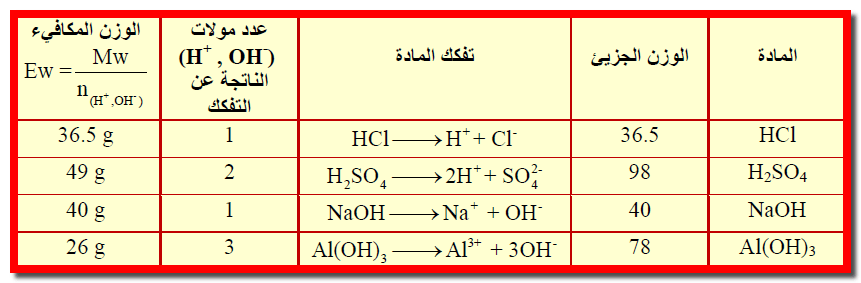
مثال (1): أحسب الوزن المكافئ للمواد التالية : HCl – H2SO4 – NaOH – Al(OH)3
علماً بأن الأوزان الذرية كالتالي ( H =1 , O =16 , Na =23 , Al =27 , S =32 , Cl =35.5 )
الحل :
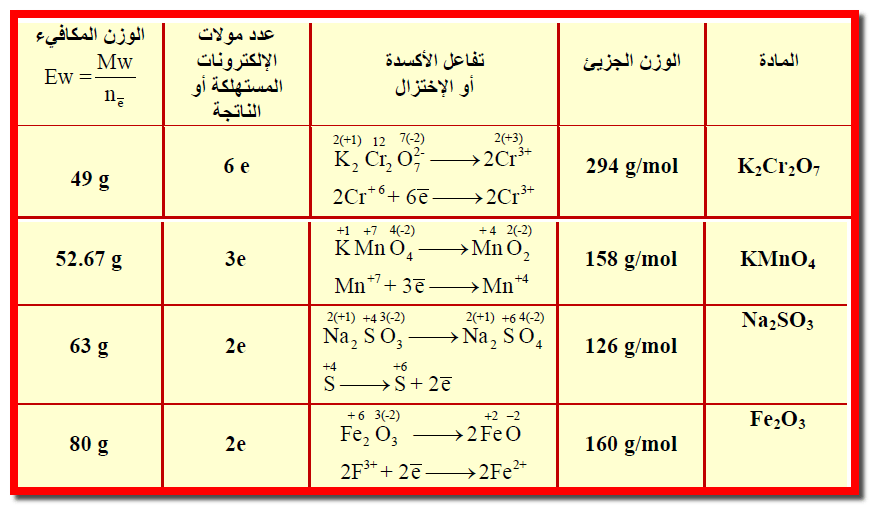
مثال (2) : أحسب الوزن المكافئ لكل مما يلي:
1- دايكرومات البوتاسيوم K2Cr2O7 عند إختزالها إلى Cr+3
2- برمنجنات البوتاسيوم KMnO4 عند اختزاله إلى MnO2
3-Na2SO3 إلى Na2SO4
4- Fe2O3 إلى FeO
علماً بأن الأوزان الذرية كالتالي : ( O =16 , K =39 , Cr =52 , Mn =55 , Na =23 , S =32 , Fe =56 )
العلاقة بين المولارية (M) والعيارية (N)
حيث n : تعبر عن عدد المولات من وحدات أيونات الهيدروجين (H+) أو الهيدروكسيد (OH–) أو عدد الإلكترونات المشاركة فى تفاعلات الأكسدة والاختزال .
العلاقة بين عدد المكافئات الجرامية (Eq) وعدد المولات (n)
حيث n : تعبر عن عدد المولات من وحدات أيونات الهيدروجين (H+) أو الهيدروكسيد (OH–) أو عدد الإلكترونات المشاركة فى تفاعلات الأكسدة والاختزال .
مسائل محلولة
مثال (3): أوجد عدد الأوزان المكافئة (3 mol H3PO4) ؟
الحل :
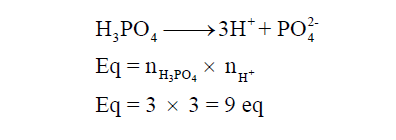
مثال (4): احسب عيارية محلول NaOH الذي يحتوي على 16 g من NaOH في 400 ml من المحلول ؟ علماً بأن الكتل الذرية : (H = 1, O = 16, Na = 23)
الحل :
مثال (5): أحسب التركيز بالعيارية لحمض H3PO4 تركيزه 0.3 M ؟
الحل :
مثال (6): أحسب عيارية محلول HCl في الماء إذا أذيب (0.5 eq HCl) في كمية من الماء بحيث يصبح حجم المحلول (500ml) ؟
الحل:
مثال (7): كم جراماً من هيدروكسيد الصوديوم الذي يوجد في 500ml من محلول NaOH عياريته 0.0412N
علماً بأن الكتل الذرية : (H = 1, O = 16, Na = 23)
الحل:
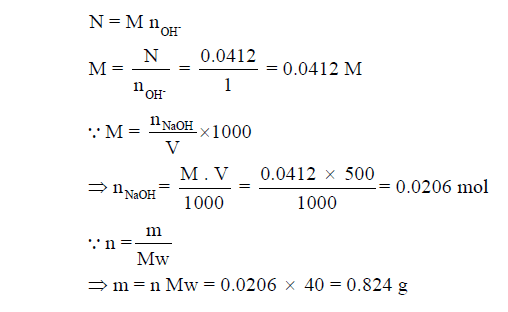
أمثلة وتمارين أخري على العيارية
لمزيد من التمارين والأمثلة والعلاقات الرياضية المتعلقة بالعيارية تابع الفيديوهات المهمة الآتي:
الفيديو الأول
الفيديو الثاني
المراجع : العيارية Normality – الفصل الأول / طرق التعبير عن التركيز من كتاب أسس الكيمياء العامة والفيزيائية للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء كلية العلوم -جامعة أم القري.

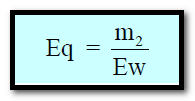
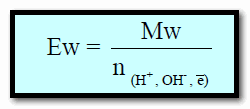
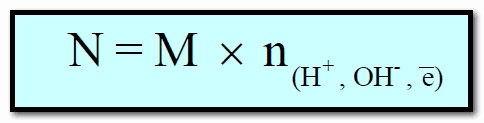
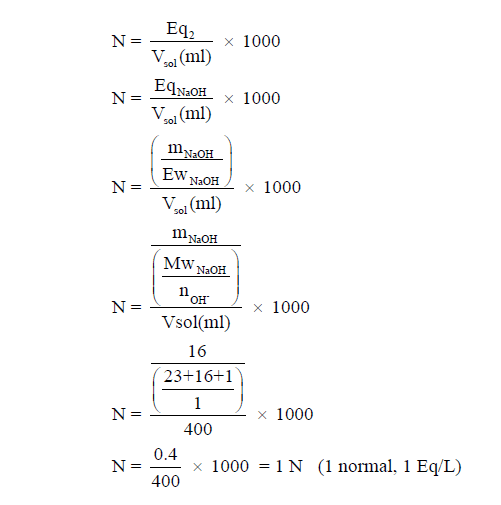
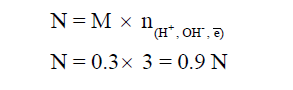
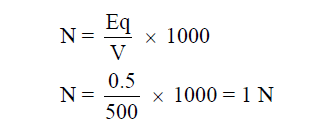






حفظكم الله دكتور مواضيع وجهود علمية أكثر من رائعة تشكرون عليها كثيرا وكل التقدير لكم اليمن.
اهلاً وسهلاً بك عزيزى لكم كل الحب و التقدير
مشكورين
اهلاً وسهلاً بك عزيزى لكم كل الحب و التقدير
والله مشكورين والله يديكم العافية والصحة لكم كل الحب والتقدير
thank you very much
Thank you very much
شكرا دكتور مواضيعكم هادفة جدا
كل الحب والتقدير لشخصكم الرائع
تسلم شكراً لك