مسائل محلولة على حاصل الإذابة (Solubility product (Ksp
قبل البدء في حل مسائل محلولة على حاصل الإذابة (Solubility product (Ksp والاطلاع عليها يجب عليك قراءة الموضوعات الآتية حتى تقوم بمراجعة القوانين المستخدمة في كل هذه المسائل: (فقط أضغط على العنوان للقراءة الموضوع).
(1) الإذابة وحاصل الإذابة Solubility and solubility product
(2) العوامل المؤثرة على حاصل الإذابة Factors affecting solubility product
(3) تطبيقات حاصل الإذابة على عملية الترسيب + مسائل محلولة
وإليكم (11) مسألة محلولة عن حاصل الإذابة وسوف نسردها كما يلي:
مسائل محلولة على حاصل الإذابة Ksp
مثال (1): أحسب حاصل الإذابة لكرومات الفضة AgCrO4 (الوزن الجزيئي هو 332) إذا علمت أن ذوبانيتها هي 0.022 جم / لتر ؟
الحل:
سيكون حل هذه المسألة كما يلي:
مثال (2): تترسب الفضة في محلول بإضافة أيون الكلوريد في محلول حجمه 500 سم3 . ما هو تركيز ايون الكلوريد إذا لم يبق أكثر من 0.1 ملجم من الفضة غير مترسب ؟
الحل:
سيكون حل هذه المسألة كما يلي:
مثال (3): احسب كمية الإذابة بالجم / لتر لهيدروكسيد الرصاص Pb(OH)2 إذا علمت أن حاصل الإذابة لــــ Pb(OH)2 هي 2.5 × 10-16 ؟
الحل:
سيكون حل هذه المسألة كما يلي:
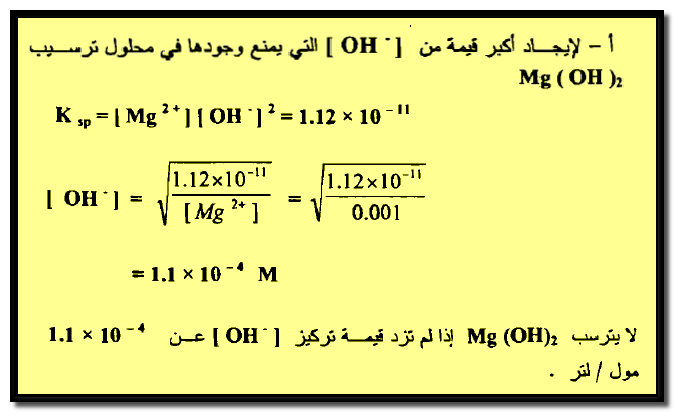
مثال (4): أحسب تركيز أيون الأمونيوم NH4+ الناتج عن NH4Cl اللازم لمنع Mg(OH)2 من الترسيب في لتر من محلول يحتوي علي 0.01 مول من الأمونيا و 0.01 مول من Mg+2 مع العلم أن ثابت التأين للأمونيا 1.8 × 10-5 وحاصل إذابة Mg(OH)2 يساوي 1.12 × 10-11 ؟
الحل:
سيكون حل هذه المسألة كما يلي:
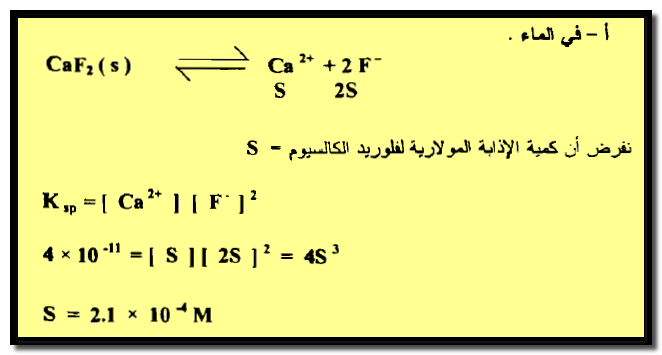
مثال (5): احسب الإذابة المولارية لفلوريد الكالسيوم ( حاصل الإذابة 4 × 10-11 ) :
(أ) في الماء
(ب) في محلول كلوريد الكالسيوم تركيزه 0.01M
(جـ) في محلول فلوريد الصوديوم تركيزه 0.01 M
الحل :
سيكون حل هذه المسألة كما يلي:
مثال (6):
أحسب الإذابة المولارية لـــ CaF2 في محلول حمض الهيدروكلوريك ذو دالة هيدروجينية تساوي 3 مع العلم أن Ksp لفلوريد الكالسيوم هي 4 × 10-11 وإن Ka لحمض فلوريد الهيدروجين HF هو 6 × 10-4
الحل :
سيكون حل هذه المسألة كما يلي:
مثال (7): على حاصل الإذابة Ksp
أحسب إذابة CaC2O4 في محلول HCl ذي أس هيدروجيني يساوي 3 مع العلم أن Ksp لأوكزالات الكالسيوم هي 2× 10-9 وأن Ka1= 6.5 × 10-2 Ka2= 6.1 × 10-5
الحل:
سيكون حل هذه المسألة كما يلي:
مثال (8): شبع محلول 100 سم3 ذو تركيز 0.1M من كل من Cu2+ و Mn2+ و 0.20M من [ H3O+ ]:
أولاً: اثبت أي من كبريتيد المعدن يترسب أولاً مع العلم أن Ksp للــ CuS هي 4 × 10-38 وللــ MnS هي 1 × 10-16
ثانياً : ما تركيز أيون الهيدروجين الذي عنده يبدأ راسب كبريتيد المنجنيز بالترسيب . تركيز أيون الكبريتيد اللازم حتى يكون Ksp = [ Mn+2 ] [ S2- ]
الحل :
مثال (9): احسب الأس الهيدروجيني الذي تبدأ الهيدروكسيدات الآتية بالترسيب في محلول يحتوي على 0.1M من كل من الأيون الموجب مع العلم أن Ksp لهيدروكسيد الحديديك Fe (OH)3 = 1×10-36 ولهيدروكسيد الماغنسيوم Mg(OH)2 = 1×10-11
الحل :
سيكون حل هذه المسألة كما يلي:
مثال (10): احسب الإذابة المولارية للـــ AgCl في 0.01 من الأمونيا ( يمثل هذا التركيز النهائي لجزئيات النهائي لجزئيات الامونيا الحرة فى المحلول ) مع العلم ان حاصل الإذابة لــ AgCl وثابت الاتزان:
K1 = 2.3 × 103
K2 = 6 × 103
الحل :
سيكون حل هذه المسألة كما يلي:
مثال (11): كم عدد جرامات Zn2+ وعدد جرامات Cd2+ التي يمكن أن يبقي ذائباً في 200 مل من محلول HCl + H2S علماً بأن تركيز الكبريتيد هو1.5 × 10-23 وأن حاصل إذابة ZnS = 1.2 × 10-23 وأن حاصل إذابة CdS = 3.6 × 10-29
الحل :
سيكون حل هذه المسألة كما يلي:
المراجع : الباب الثالث / الإذابة وحاصل الإذابة Solubility and solubility product من كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي ) للمؤلف / محمد مجدي عبدالله واصل.



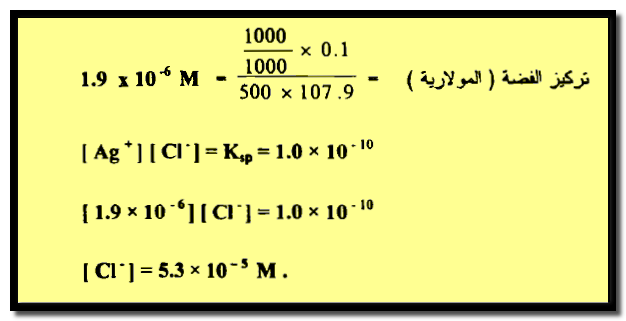

















جميلل
شكراً لك وأهلاً بك دائماً فى موقعنا
شكراً جزيلاً على المساعدة الكبيره التي توفرونها لنا نحن بأمس الحاجه الي منشوراتكم هذه أرجو الأستمرار