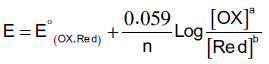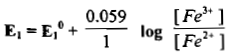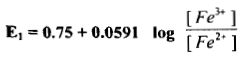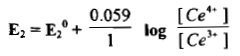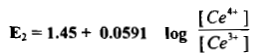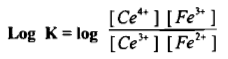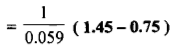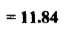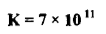منحنيات معايرة الأكسدة والاختزال Redox Titration Curves
محتويات الموضوع
تعريف منحنيات معايرة الأكسدة والاختزال
– یتم رسم منحنیات معايرة الأكسدة والاختزال Redox Titration Curves بالاستعانة بمعادلة نرنست.
– یعبر منحنى المعایرة عن التغیر في تركیز المادة المراد تعینها ، وذلك بدلالة المادة القیاسیة.
– توضح معادلة نرنست العلاقة بین الجهد والتركیز بذلك یمكن تمثیل منحنى معایرة الأكسدة والاختزال برسم العلاقة بین مللترات المادة القیاسیة (یمكن أن یكون عاملاً مختزلاً أو مؤكسداً) وقیم الجهد التي تقابل كل إضافة.
– ویتم حساب الجهد باستخدام معادلة نرنست التي توضحها العلاقة التالیة:
– حیث تحسب قیم هذا الجهد مع التغیر في تركیز محتویات الخلیة أثناء المعایرة ویستخدم نصف الخلیة القياسي (H+/H2) لتقوم بدور نصف خلیة مقارنة.
– أما في المعمل فیستخدم قطب الكالومیل المشبع كقطب مقارنة وذلك للحصول على منحنى المعایرة في التجارب العملیة.
– أن الوسیلة المناسبة لتوضیح هذه الحسابات هو استخدام تفاعل السیریوم الرباعي Ce+4 مع الحدید الثنائي Fe+2
كيفية رسم منحنيات معايرة الأكسدة والاختزال
– لرسم منحنى معايرة الأكسدة والاختزل سيتم دراسة مثال فعلى وهو معايرة 100 مل من محلول الحديدوز (0.1N) Fe+2 مع محلول السيريوم الرباعي Ce+4 مع الحديد الثنائي في وجود حمض الكبريتيك (1N) H2SO4.
– إن معادلة التفاعل التأكسدية الاختزالية لهذا التفاعل هي كما يلي:
– الكمية التي تقابل [H+] في المعايرات الحامضية القاعدية هنا هي النسبة [OX] / [Red] حيث يوجد عندنا هنا منظومتان من هذا النوع هما كما يلي:
– إذا طبقنا معادلة نرنست على المنظومة (1) عند درجة 25 مo تكون قيمة جهد القطب لها كما يلي:
– ومن جداول جهود الأقطاب القياسية نجد أن E1 = 0.75 V وعليه تكون المعادلة كما يلي:
– يكون جهد القطب بالطريقة نفسها للمنظومة (2) كما يلي:
– يكون ثابت التوازن لهذا التفاعل كما يلي:
– وتدل قيمة ثابت التوازن الإيجابية العالية على أن التفاعل يجري بصورة تامة وكاملة وهو صالح لإجراء المعايرة والتعين الكمي للحديد.
– في أثناء زيادة محلول سيريوم (IV) إلى أن تصل إلى نقطة التكافؤ يكون تأثيره هو في أكسدة الحديد الثنائي وبالنتيجة تبدل النسبة [Fe+3 / Fe +2]
(1) إضافة 10ml من محلول Ce+4
– عند زيادة10 ml من محلول الكاشف المؤكسد وهو محلول Ce+4 إلى 100 ml من محلول الحديد الثنائي يصبح الحجم الكلي 110 ml وعليه فإن تركيز Fe+3 المتكون يكون:
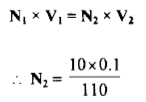
– وتركيز [Fe+2] المتبقي بعد التفاعل مع 10 ml من محلول السيريوم الناتج كما يلي:
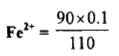
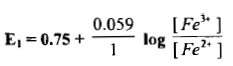

(2) إضافة 20ml من محلول Ce+4
– بالطريقة نفسها نحسب E1 عند زيادة 20 ml من محلول السيريوم إذ تكون كما يلي:
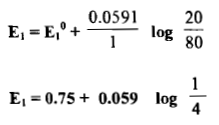
(3) إضافة 50ml من محلول Ce+4
– نستمر بزيادة محلول السيريوم وحساب الجهد فعند زيادة 50 مل من المحلول المؤكسد يكون الناتج كما يلي:
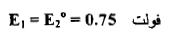
(4) إضافة 90ml من محلول Ce+4
– عند إضافة 90 ml من المحلول المؤكسد يكون الناتج كما يلي:

(5) إضافة 99ml من محلول Ce+4
– عند إضافة 99 ml من المحلول المؤكسد يكون الناتج كما يلي:

(6) إضافة 99.9 من محلول Ce+4
– عند إضافة 99.9 ml من المحلول المؤكسد (أى قبل نقطة التكافؤ بـ 0.1 ml) تكون كما يلي:

(7) إضافة 100ml من محلول Ce+4 (نقطة التكافؤ)
– عند نقطة التكافؤ أي إضافة 100 ml من محلول السيريوم الرباعي إلي 100 ml من محلول الحديد الثنائي فيكون كما يلي:
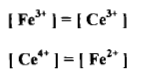
– بحسب جهد القطب كما يأتي:
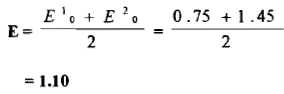
(8) إضافة 100.1ml من محلول Ce+4 (بعد نقطة التكافؤ)
– بعد نقطة التكافؤ فإن الاستمرار في زيادة محلول السيريوم الرباعي يعني زيادة نسبة [Ce+4 / Ce +3] فإذا كان حجم المزاد من المحلول المؤكسد هو 100.1 ml فإن المتبقي من حجم Ce+4 هو 0.1 ml وإن تركيزه عندئذ يكون كما يلي:
[Ce+4] =( 0.1 × 0.1) /100.1
– وذلك من القانون : N1 × V1 = N2 × V2 ويكون:
[Ce+3] = ( 0.1 × 0.1) /100.1
ومن ثم فأن:
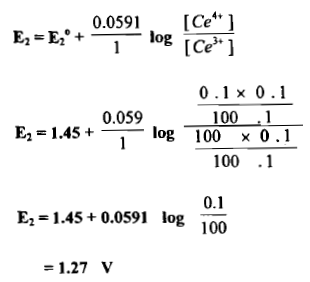
(9) إضافة 101ml من محلول Ce+4

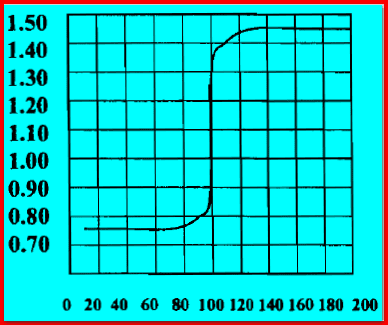
(10) رسم منحنى معايرة الأكسدة والأختزال
من ربط العلاقة بين الحجوم المزاده من محلول الكاشف المؤكسد وقيم جهود الأختزال المحسوبة نحصل على الشكل التالي للتفاعل السابق:
مثال آخر لرسم منحنى معايرة الأكسدة والاختزال
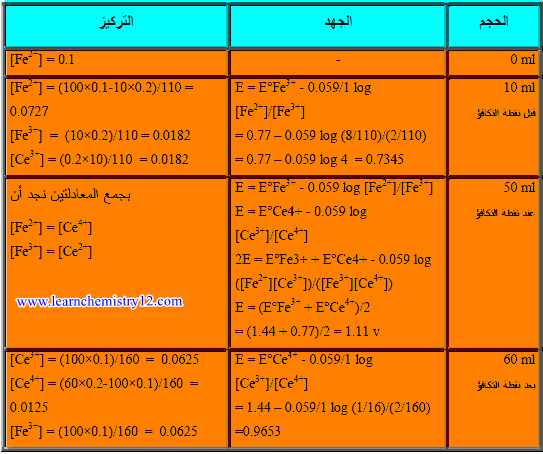
– مثال آخر لرسم منحنى معايرة الأكسدة والاختزال وهو دراسة معايرة 100 ml من محلول الحديد الثنائي تركيزه 0.1 N بمحلول السيريوم الرباعي تركيزه 0.2 N
N1 × V1 = N2 × V2
0.1 × 100 = 0.2 × V2
– وبالتالي فأن نقطة التكافؤ عند حجم V2 من السيريوم الرباعي يساوي = 50 ml
– الجدول التالي يوضح الحجوم المضافة من السيريوم الرباعي والقوانين المطبقة لرسم منحنى معايرة الأكسدة والاختزال كما يلي:
المراجع:
- كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي) / محمد مجدي عبد الله واصل جامعة الأزهر الشريف / دار الفجر للنشر والتوزيع / القاهرة
- كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها
- محاضرات الكيمياء التحليلية (التحليل الحجمى والوزني) / خيرية محمد عبدالله الأحمري /(1430 – 1429 هـ ) / جامعة الملك عبد العزيز- المملكة العربية السعودية.