تجربة تقدير تركيز برمنجانات البوتاسيوم بواسطة حمض الأوكساليك

الخلفية النظرية لتجربة تقدير تركيز برمنجانات البوتاسيوم بواسطة حمض الأوكساليك
– تجربة تقدير تركيز برمنجانات البوتاسيوم بواسطة محلول قياسي من حمض الأوكساليك هي أحدى تطبيقات معايرات الأكسدة والاختزال.
– أن برمنجانات البوتاسيوم عامل مؤكسد قوي خصوصاً في الوسط الحمضي تصل برمنجانات البوتاسيوم إلى قوتها التأكسدية القصوى كما هو واضح من خلال المعادلة الآتية كما يلي:
– أو من خلال المعادلة الإلكترونية الآتية كما يلي:
– يعتبر حمض الكبريتيك وسط حامضي مناسب وذلك لعدم تأثيره على البرمنجات فى المحاليل المخففة.
– ولا يوصي باستخدام حمض الهيدروكلوريك لأن بعضاً من البرمنجانات سوف تستهلك في أكسدة حمض الهيدروكلوريك إلى الكلور حسب التفاعل التالي:
– في هذه التجربة فأن التفاعل بين حمض الأوكساليك وبرمنجانات البوتاسيوم يكون كالتالي:
أو بالصيغة الأيونية كما يلي:
الأدوات والمواد المستخدمة في تجربة تقدير تركيز برمنجانات البوتاسيوم بواسطة حمض الأوكساليك
يجب توفير الأدوات والمواد الآتية كما يلي قبل بدء التجربة:
(1) سحاحة Burette
(2) ماصة Pipette
(3) دورق قياسي (100 مل) Volumetric flask
(4) دورق مخروطي Conical flask
(5) كأسين Beakers
(6) قمع Funnel
(7) محلول قياسي من حمض الأوكساليك Oxalic Acid H2C2O4
(8) محلول برمنجانات البوتاسيوم (مجهول التركيز) Potassium Permanganate KMnO4
(9) حمض الكبريتيك المخفف dil. Sulphuric Acid
ملاحظات هامة فى هذه التجربة
(1) يراعى في هذه المعايرة تسخين محلول حمض الأوكساليك إلى حوالي 60-90 درجة مئوية حتى لا يتكون راسب بني أثناء المعايرة.
(2) محلول حمض الاوكساليك محلول قياسي
(3) لا يوجد دليل للمعايرة وذلك لأن برمنجانات البوتاسيوم نفسها تعتبر الدليل (دليل ذاتي) وذلك نظراً لكونها بنفسجية اللون وعند اختزالها تصبح عديمة اللون.
خطوات تجربة تقدير تركيز برمنجانات البوتاسيوم بواسطة حمض الأوكساليك
نتبع الخطوات الآتية كما يلي بالترتيب:
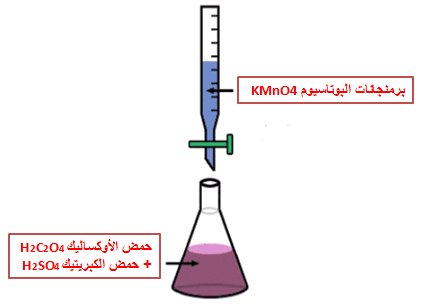
(1) بعد تنظیف السحاحة بالماء المقطر تنظف بقلیل من محلول البرمنجانات المجهولة التركیز ثم إملاء السحاحة بمحلول البرمنجانات وأضبط المحلول على صفر التدریج وتأكد من عدم وجود فقاعات هوائیة وتأكسد من امتلاء الجزء السفلي تحت الصنبور .
(2) انقل بالماصة 10 مل من حمض الأوكساليك ( مادة سامة) إلى دورق مخروطي.
(3) أضف كمية مماثلة من حمض الكبريتيك المخفف.
(4) سخن المحلول إلى حوالي 60-90 درجة مئوية (قبل الغليان).
(5) أضف البرمنجانات ببطء من السحاحة والمحلول ساخن حتى يبدأ ظهور اللون الوردي الفاتح.
ملحوظة هامة جداً:
إذا تكون راسب بني أثناء المعايرة فإن ذلك يرجع إلى إحدى العوامل التالية:
(أ) درجة الحرارة قد تكون أقل من 60 درجة مئوية ولذلك سخن دائماً حتى تظل درجة الحرارة مناسبة.
(ب) أن إضافة البرمنجانات قد حدثت بسرعة
(جـ) كمية حمض الكبريتيك المضافة غير كافية
(6) تؤخذ قراءة السحاحة وتسجل كقراءة نهائية.
(7) كرر التجربة مرتين وخذ المتوسط. مع ملاحظة تسخين محلول حمض الأوكساليك حتى درجة 60-90 درجة مئوية كما سبق والمعايرة قبل أن يبدأ.
(8) احسب عيارية وقوة محلول برمنجانات البوتاسيوم.
الحسابات والقوانين الرياضية
(أ) في حالة استخدام التركيزات بالعيارية (N)
– تحسب عيارية محلول برمنجانات البوتاسيوم كالتالي:
(KMnO4) N1 × V1 = N2 × V2 (H2C2O4)
– قوة البرمنجانات (Strength) تحسب بالعلاقة الآتية كما يلي:
قوة البرمنجانات (جم/لتر) = العيارية × الوزن المكافيء
S = N × eq. weight
(ب) في حالة استخدام التركيزات بالمولارية (M)
– من معادلة التفاعل الموزونة نجد أن:
2mol KMnO4 = 5mol H2C2O4
– عدد مللي مولات البرمنجانات = عدد مللي مولات الأوكسالات
(KMnO4) M1× V1 = M2 × V2 (H2C2O4)
– لكي يتم تكافؤ عدد ملل مولات سيتم ضرب مللي مولات البرمنجانات × 5 ، وضرب مللى مولات الاوكسالات × 2 ويكون:
(KMnO4) 5( M1 × V1) = 2(M2 × V2) (H2C2O4)
حيث V1 هو متوسط حجم برمنجانات البوتاسيوم من السحاحة بعد المعايرة.
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة الآتي:
(1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به.
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها ، ولا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض.
(3) يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف.
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها.
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط.
(6) يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات ويجب الانتباه عند تغطية زجاجات الكيماويات.
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها ، واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلامة.
(8) عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي.
(9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط ، بلل الزجاج بالماء أو الزيت أولاً لان ذلك يسهل ألي حد كبير هذه العملية.
احتياطات أخرى
(10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه.
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر ، ومراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء.
(12) يجب أن يكون بكل مختبر أكثر من مخرج ويفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج.
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يوميا ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة.
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه.
(15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر.
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وان تكون مزودة بمروحة سحب مناسبة.
المراجع:
- كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها
- أساسيات الكميياء التحليلية عملي /165 كيم/ المؤسسة العامة للتدريب المهني والتقنى / طبعة 1429هـ/ السعودية
- الكيمياء التحليلية الكمية (التحليل الحجمى والوزني) الجزء العملي للفصل الدراسي الثاني للفرقة الثانية كيمياء/ ريم محمد الغانمي/1429 – 1430 هـ/ جامعة الملك عبد العزيز/ السعودية