المحاليل القياسية Standard Solutions فى التحليل الحجمي
– في هذا الموضوع سيتم شرح المحاليل القياسية المستخدمة فى عملية التحليل الحجمي
محتويات الموضوع
تعريف المحاليل القياسية Standard solutions
– المحاليل القياسية تعرف بأنها محاليل يحتوي الحجم المعين منها على وزن معين من المادة المذابة.
– وهكذا تكون هذه المحاليل ذات درجة تركيز معلومة ودقيقة بالضبط.
– تحضر المحاليل ذات التراكيز الثابتة كما يلي: بإذابة وزن مضبوط بدقة من مادة تكون على درجة عالية من النقاوة والثبات.
– كما تسمى بالمادة القياسية الأولية Primary standard substance في حجم معين لتعطي التركيز اللازم بالضبط.
شروط المادة القياسية الأولية
(1) ذات تركيب معروف، ويسهل الحصول عليها بدرجة عالية من النقاوة (99%) أو من السهل تنقيتها بعد الكشف أو معرفة الشوائب التى تنبغي أن تتجاوز 0.2% كما يسهل تجفيفها (100 -120 Co) وحفظها في حالة نقية. ومن الصعب أن تتوفر هذه المميزات في المواد المائية.
(2) أن تكون المادة غير متميعة Non hydroscopic كما يجب ان لا تكون قابلة لأي تغير فيها في أثناء عملية الوزن.
(3) يجب أن يكون وزنها المكافئ كبيراً حتى تصبح أخطاء الوزن في حدود الإهمال.
(4) كما يجب أن تكون المادة سهلة الذوبان في الماء تحت الظروف التي تستعمل فيها.
(5) أن يكون التفاعل مع المادة القياسية من التفاعلات التي تظهر تماماً عند نقطة التكافؤ وأن يتم بسرعة.
(6) يجب أن لا يكون محلول المادة القياسية الأولية ملوناً قبل انتهاء عملية المعايرة أو بعدها منعاً لتداخل لونها مع لون الدليل المستعمل لإيجاد نقطة انتهاء التفاعل.
(7) علاوة على ذلك يجب أن لا تتأثر بالضوء ودرجات الحرارة والغبار والمواد العضوية.
المحاليل القياسية المستخدمة فى التحليل الحجمي
(1) في حالة تفاعلات التعادل
من المواد القياسية المستخدمة فى حالة تفاعلات التعادل أثناء التحليل الحجمي هى كما يلي:
- كربونات الصوديوم Na2CO3
- البوراكس Na2b4O7.10H2O
- فثالات البوتاسيوم الحامضية C8H5O4K
- حمض الهيدروكلوريكHCl
- يوديدات البوتاسيوم الحامضية KHIO3
- حمض السكسنيك H2C4H4O4
- حمض البنزويك C6H5COOH
- حمض الفورميك CH2O2
- حمض الأوكزاليك H2C2O4
(2) في حالة تفاعلات الأكسدة والاختزال
من المواد القياسية المستخدمة فى حالة تفاعلات الأكسدة والاختزال أثناء التحليل الحجمي هى كما يلي:
- ثنائي كرومات البوتاسيوم K2Cr2O7
- برومات البوتاسيوم KBrO3
- أيودات البوتاسيوم KIO3
- أيودات البوتاسيوم الحمضية KHIO3
- اليود I2
- أوكزالات الصوديوم Na2C2O4.
(3) في حالة تفاعلات الترسيب
من المواد القياسية المستخدمة فى حالة تفاعلات الترسيب أثناء التحليل الحجمي هى كما يلي:
- الفضة Ag
- نترات الفضة AgNO3
- نترات الزئبقيك HgNO3
- كلوريد البوتاسيوم.
تحضير المحاليل القياسية التقريبية
Preparation of Approximately Standard Solutions
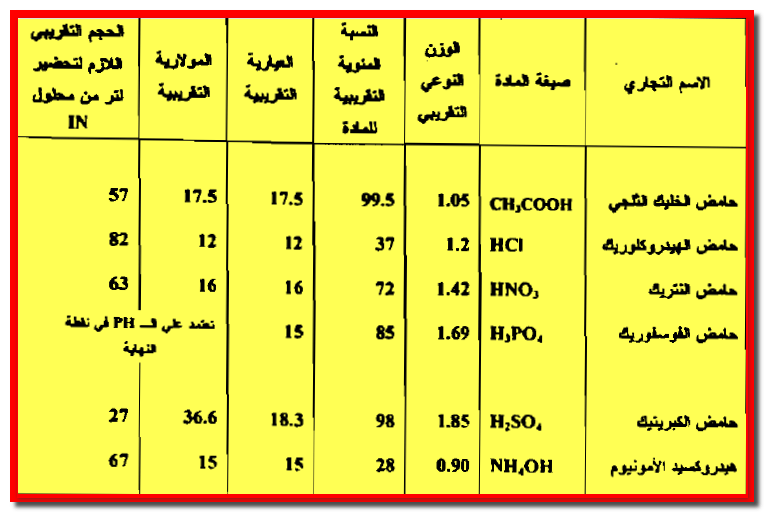
(1) نحسب وزن المادة في لتر من المحلول بضرب الوزن النوعي في 1000 وذلك للحصول على عدد جرامات المحلول فى كل لتر.
– ثم نضرب هذه النتيجة بالنسبة المئوية للمكون فتحول النسبة إلى كسر عشري ويربط هاتين العمليتين.
– وباستعمال حمض HCl المركز بوصفه مثالاً نحصل على 1000 مل × 1.23 × 0.37 = 445 جم HCl / لتر HCl مركز (إذ أن 1.2 هي الوزن النوعي 0.37 هي النسبة المئوية لـــ HCl محلولة إلى كسر عشري).
(3) نطبق معادلة التخفيف N1V1 = N2V2 وذلك بالتعويض عن العيارية المحسوبة والحجم المراد تحضيره من المحلول الجديد ( لتر) للحصول على حجم المحلول المركز الذي يجب أخذه وتخفيفه إلى لتر.
12.2 × V1 = 1 × 1000
V1 = 1000 / 12.2 = 82 ml
82 مل من محلول الحامض المركز يجب أخذه وتخفيفه إلى 1000 مل بالماء المقطر للحصول على محلولHCl عياريته 1N تقريباً







