منحنى معايرة حمض ضعيف مع قاعدة ضعيفة
– في هذا الموضوع سيتم استنتاج ورسم منحنى معايرة حمض ضعيف مع قاعدة ضعيفة
Titration Curve of a weak base with a weak acid
تعريف منحنى المعايرة Titration Curve
– منحنى المعايرة هو المنحنى الذي يمثل العلاقة بين حجم الحمض المتعادل (أو حجم القاعدة التي تعادل أجزاء مختلفة من القاعدة) والرقم الهيدروجيني للمحلول.
– يمثل التغير في الرقم الهيدروجيني في المنطقة المجاورة لنقطة التعادل أهمية كبيرة في إختيارالدليل المناسب الذي يعطي أقل خطأ في المعايرة.
– يعتمد المنحنى على نوع الحمض ونوع القاعدة والتركيز.
– سوف نتطرق بالتفصيل لدراسة وكيفية رسم منحنيات المعايرة لمختلف أنواع تفاعلات الأحماض مع القواعد وذلك عن طريق الحسابات النظرية للرقم الهيدروجيني.
منحنيات معايرة الأحماض والقواعد
– أضغط على المعايرة التي تريدها لقراءة الموضوع كاملاً كما يلي:
(1) منحنى معايرة حمض قوي مع قاعدة قوية
(Titration of strong acid with strong base)
(2) منحنى معايرة حمض ضعيف مع قاعدة قوية
(Titration of weak acid with strong base)
(3) منحنى معايرة قاعدة ضعيفة مع حمض قوي
(Titration of strong acid with weak base)
(4) منحنى معايرة حمض ضعيف مع قاعدة ضعيفة
(Titration of weak acid with weak base)
– ولكن خلال هذا الدرس سوف نشرح فقط كيفية استنتاج منحنى معايرة حمض ضعيف مع قاعدة ضعيفة.
منحنى معايرة حمض ضعيف مع قاعدة ضعيفة
– إن هذا النوع من المعايرات قليل الاستخدام لأن مدي التغير في الرقم الهيدروجيني في منطقة التكافؤ يكون بطيئاً وصغيراً للغاية بحيث لا يمكن معه استخدام أي من الأدلة البسيطة لتحديد نقطة التكافؤ.
– لرسم منحنى المعايرة في هذه الحالة لابد من حساب الرقم الهيدروجيني في أربع مناطق مميزة من المنحنى وهي قبل بداية التفاعل و قبل الوصول لنقطة التكافؤ وعند نقطة التكافؤ وبعدها.
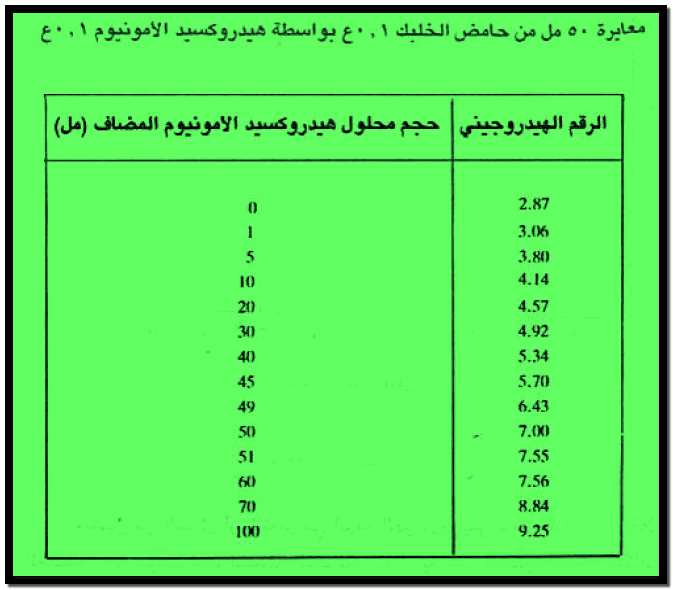
– يمكن تمثيل معايرة حمض ضعيف مع قاعدة ضعيفة بدراسة معايرة 50 مل من محلول حمض الخليك 0.1N بواسطة محلول هيدروكسيد الامونيوم 0.1N علماً بأن ثابت التأين لهيدروكسيد الامونيوم يساوي:
Kb= 1.75 × 10-5
pKb = – log Kb = 4.756
– سوف نتتبع التغير الذي يحدث فى الرقم الهيدروجيني للمحلول خلال المراحل الأربعة السابق ذكرها لنتمكن من رسم منحنى المعايرة.
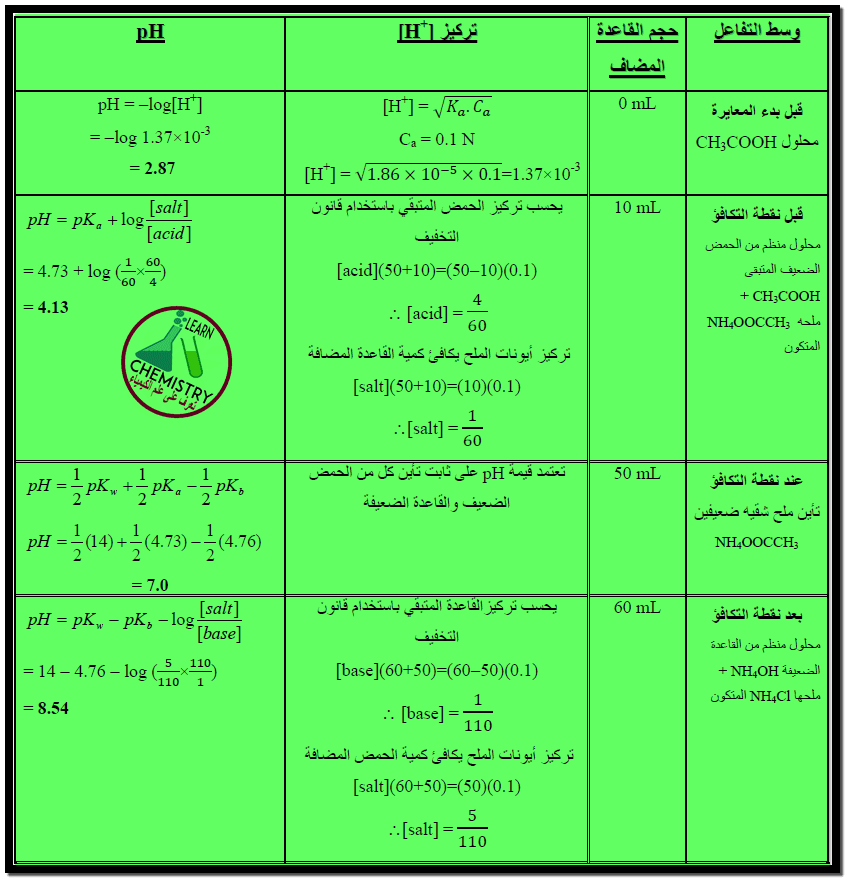
(1) قبل بدء المعايرة
– يحسب الرقم الهيدروجيني في هذه الحالة من تركيز حمض الخليك وثابت تأينه حسب العلاقة الآتية كما يلي:
[pH = 1/2 pKa – 1/2 log [acid
= 1/2 X 4.74 – 1/2 log 0.1
= 2.37 + 0.5 = 2.87
(2) قبل نقطة التكافؤ
– في هذه الحالة سيكون في المحلول حمض الخليك وأيونات الخلات وأيونات الأمونيوم التي تتميه في المحلول حسب المعادلة الآتية كما يلي:
– وحيث أن المحلول حامضي فإن الاتزان الثاني ينزاح إلى اليسار وهذا يحد من تميه الأمونيوم.
– بهذا يمكننا اعتبار المحلول كمحلول منظم من حمض الخليك و خلات الصوديوم الذي يمكن حساب رقمه الهيدروجيني كما بالعلاقة الآتية:
pH = pKa + log [salt] / [acid]
– فمثلاً بعد إضافة 10 مل من محلول هيدروكسيد الأمونيوم 0.1 N يكون تركيز الملح الناتج كما يلي:
[salt] = [NH4+]
= (10×0.1) / (50+10)
= (50×0.1) – (10×0.1) / (50+10) [acid]
– وبالتعويض في العلاقة السابقة:
pH = 4.74 + log (0.017 / 0.067) = 4.14
– بنفس الطريقة يمكن حساب الرقم الهيدروجيني للمحلول بعد كل إضافة من المحلول المعاير إلى ما قبل نقطة التكافؤ.
(3) عند نقطة التكافؤ
– أي بعد إضافة 50 مل من محلول هيدروكسيد الأمونيوم
– يكون في المحلول في هذه الحالة ملح خلات الأمونيوم الذي يتأين ويتميه شقيه الناتجين كما هو موضح سابقاً.
– يحسب الرقم الهيدروجيني للمحلول من علاقة تميه ملح شقيه ضعيفين كما يلي:
pH = 1/2 pKw – 1/2 pKa – 1/2 pKb
– حيث أن قيمتي pKa ، pKb لحمض الخليك وهيدروكسيد الأمونيوم متساوتان تقريباً.
pKa = pKb
– بما أن pKw = 14 نعوض فى المعادلة السابقة نحصل على :
pH = 7
(4) بعد نقطة التكافؤ
– في هذه الحالة ستحد أيونات الهيدروكسيل الناتجة من هيدروكسيد الأمونيوم من تميه أيون الخلات.
– ويمكن اعتبار المحلول كمحلول منظم من تميه أيون الخلات ويمكن اعتبار المحلول كمحلول منظم مكون من هيدروكسيد الأمونيوم وخلات الأمونيوم.
– يمكن حساب الرقم الهيدروجيني للمحلول من علاقة حساب الرقم الهيدروجيني لمحلول منظم مكون من قاعدة ضعيفة وأحد أملاحها وهي كما يلي:
[pH = pKw – pKb – log [salt] / [base
– فمثلاً بعد إضافة 60 مل من محلول هيدروكسيد الأمونيوم يكون تركيز الملح :
= (50×0.1) / (50+60) [salt]
= 0.045 mol/L
= (60×0.1) – (50×0.1) / (50+60) [base]
= 0.0091 mol/L
– وبتعويض هذه القيم في العلاقة السابقة يكون :
pH = 14 – 4.75 + log (0.045 / 0.0091)
= 7.56
– الجدول التالي يبين قيم الرقم الهيدروجيني عند معايرة 50 مل من محلول حمض الخليك 0.1 N بواسطة محلول هيدروكسيد الامونيوم 0.1 N كما يلي
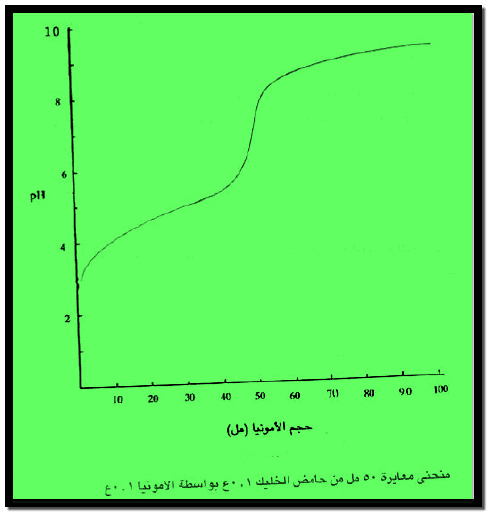
– والشكل التالي يبين منحنى معايرة حمض الخليك بواسطة هيدروكسيد الأمونيوم كما يلي:
– ويتبين من الشكل أن التغير في الرقم الهيدروجيني بطئ وتدريجي خلال المعايرة ولا سيما قرب منطقة التكافؤ، ولذلك يصعب تحديد نقطة التكافؤ بوضوح في مثل هذا النوع من المعايرات باستخدام أدلة بسيطة.
– غير أنه يمكن استخدام دليل مختلط يتغير لونه في مجال ضيق من الرقم الهيدروجيني مطابقاً للتغير عند نقطة التكافؤ.
– ومن الأدلة المستخدمة الدليل المختلط المكون من المثيلين الأزرق والمثيلين الأحمر المحضر في وسط متعادل.
ملخص طريقة رسم منحنى معايرة حمض ضعيف مع قاعدة ضعيفة
– يمكن تلخيص القوانين السابقة بالجدول الآتي كما يلي:
المراجع : – التحليل الكيميائي الكمي التقليدي لطلاب الكليات والجامعات. محمد أحمد آشي – عبد الغني حمزة – توفيق عميرة – عبد العزيز السباعي – أحمد عشي ، الطبعة الثالثة (1418هـ – 1997 م ) – جامعة الملك عبد العزيز- المملكة العربية السعودية