منحنى معايرة حمض قوي مع قاعدة قوية
في هذا الموضوع سيتم مناقشة منحنى معايرة حمض قوي مع قاعدة قوية Titration Curve of a strong acid with a strong base ولكن أولاً سنناقش نبذة مختصرة عن منحنيات المعايرات ككل.
محتويات الموضوع
تعريف منحنى المعايرة Titration Curve
– منحنى المعايرة هو المنحنى الذي يمثل العلاقة بين حجم الحمض المتعادل (أو حجم القاعدة التي تعادل أجزاء مختلفة من القاعدة) والرقم الهيدروجيني للمحلول.
– يمثل التغير في الرقم الهيدروجيني في المنطقة المجاورة لنقطة التعادل أهمية كبيرة في إختيارالدليل المناسب الذي يعطي أقل خطأ في المعايرة.
– يعتمد المنحنى على نوع الحمض ونوع القاعدة والتركيز.
– سوف نتطرق بالتفصيل لدراسة وكيفية رسم منحنيات المعايرة لمختلف أنواع تفاعلات الأحماض مع القواعد وذلك عن طريق الحسابات النظرية للرقم الهيدروجيني.
منحنيات المعايرة للأحماض والقواعد
– أضغط على المعايرة التي تريدها لقراءة الموضوع كاملاً كما يلي:
(1) منحنى معايرة حمض قوي مع قاعدة قوية
(Titration of strong acid with strong base)
(2) منحنى معايرة حمض ضعيف مع قاعدة قوية
(Titration of weak acid with strong base)
(3) منحنى معايرة قاعدة ضعيفة مع حمض قوي
(Titration of strong acid with weak base)
– ولكن خلال هذا الموضوع سوف نشرح فقط كيفية استنتاج منحنى معايرة حمض قوي مع قاعدة قوية وأن شاء الله سوف نستكمل باقي المنحنيات في الدروس القادمة.
منحنى معايرة حمض قوي مع قاعدة قوية
– إن الأحماض والقواعد القوية تتأين تأيناً كاملاً عند إذابتها في الماء وكأمثلة عليها حمض الهيدروكلوريك وحمض الكبريتيك وهيدروكسيد الصوديوم وهيدروكسيد البوتاسيوم.
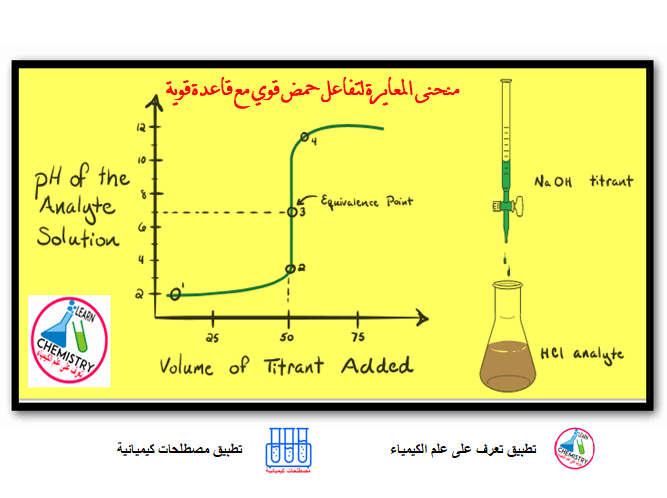
– خلال معايرة حمض قوي بقاعدة قوية يتغير الرقم الهيدروجيني للمحلول تغير اً كبيراً عند نقطة التكافؤ وبعدها فإن تغيرات الرقم الهيدروجيني تكون صغيرة وتدريجية بعد كل إضافة من المحلول المعاير.
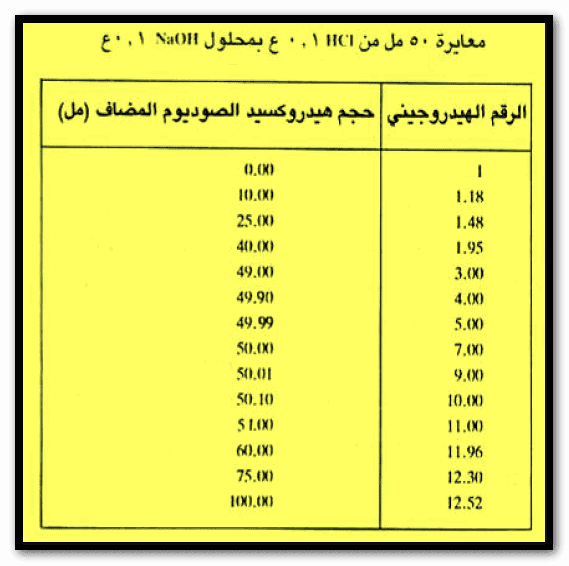
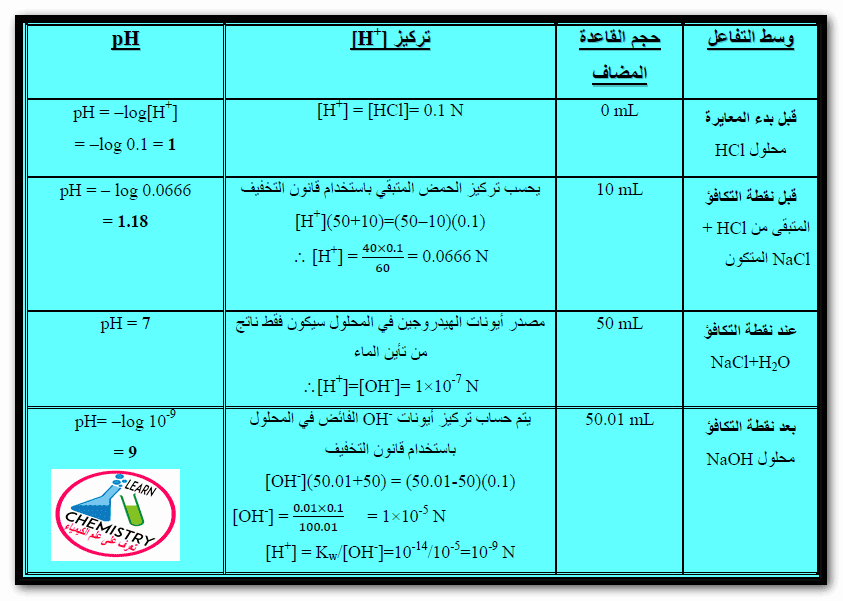
– لتوضيح ذلك سندرس معايرة 50 مل من حمض الهيدروكلوريك الذي تركيزه 0.1N بواسطة 0.1N من محلول هيدروكسيد الصوديوم.
– وسنتابع عملية تغير تركيز أيون الهيدروجين أو الرقم الهيدروجيني خلال عملية المعايرة بعد كل إضافة من محلول القاعدة.
– ولا بد لرسم منحنى المعايرة من حساب الرقم الهيدروجيني في الحالات الآتية كما يلي:
(1) قبل بداية التفاعل
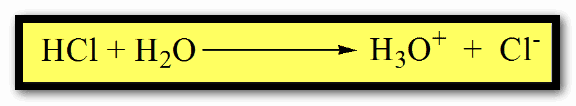
– بما أن حمض الهيدروكلوريك حمض قوي أحادي القاعدية يتأين تأيناً تاماً كما يلي:
= – log [H+] = – log 0.1 = 1 pH
(2) قبل نقطة التكافؤ
– يتغير الرقم الهيدروجيني قبل نقطة التكافؤ تغيراً تدريجياً بسيطاً.
– فمثلاً عند إضافة 1 مل من هيدروكسيد الصوديوم 0.1 N يمكن حساب الرقم الهيدروجيني للمحلول كالتالي:
[H+] = (50×0.1 – 10×0.1) / (50+10) = 0.0666
– وفي هذه الحسابات قد أهملنا تركيز أيونات الهيدروجين الناتجة من تفكك الماء لصغره مقارنة بالتركيز العالي لأيونات الهيدروجين الناتجة من التأين التام للحمض القوي.
– وبنفس الطريقة يمكن حساب الرقم الهيدروجيني للمحلول بعد كل إضافة جديدة من محلول هيدروكسيد الصوديوم.
– فمثلاً بعد إضافة 49.9 مل يمكن حساب الرقم الهيدروجيني كما يلي:
[H+] = (50×0.1 – 49.9×0.1) / (50+49.9)
(3) عند نقطة التكافؤ
– أي عند إضافة 50 مل من محلول هيدروكسيد الصوديوم 0.1N وسوف يحتوي المحلول على كلوريد الصوديوم والماء فقط.
– والتفاعل الحاصل هو كما يلي:
= 7 pH
(4) بعد نقطة التكافؤ
– أن حساب الرقم الهيدروجيني للمحلول يعد نقطة التفاعل يتطلب معرفة تركيز أيونات الهيدروكسيل الفائضة.
– فمثلاً بعض إضافة 50.01 مل من هيدروكسيد الصوديوم المتأين بصورة تامة:
– فأنه يمكن حساب الرقم الهيدروجيني للمحلول كالتالي:
نحسب تركيز أيون الهيدروكسيل الفائض من العلاقة:
[OH–] = (50.01×0.1 – 50×0.1) / (50.01+50)
– ويمكن حساب الرقم الهيدروجيني بنفس الطريقة بعد كل إضافة من الزيادة من هيدروكسيد الصوديوم.
– ويلاحظ أن التغير في الرقم الهيدروجيني صغير وتدريجي.
– والجدول التالي يبين التغير في الرقم الهيدروجيني خلال معايرة 50 مل من حمض الهيدروكلوريك الذي تركيزه 0.1 N بمحلول 0.1 N من هيدروكسيد الصوديوم.
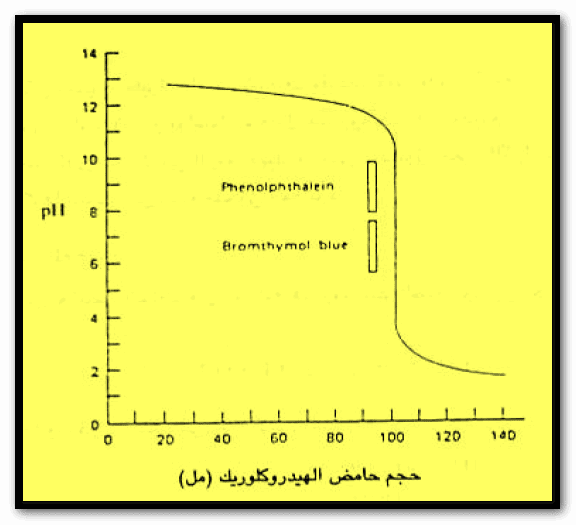
ومن البيانات فى الجدول السابق يمكن رسم المنحنى التالي:
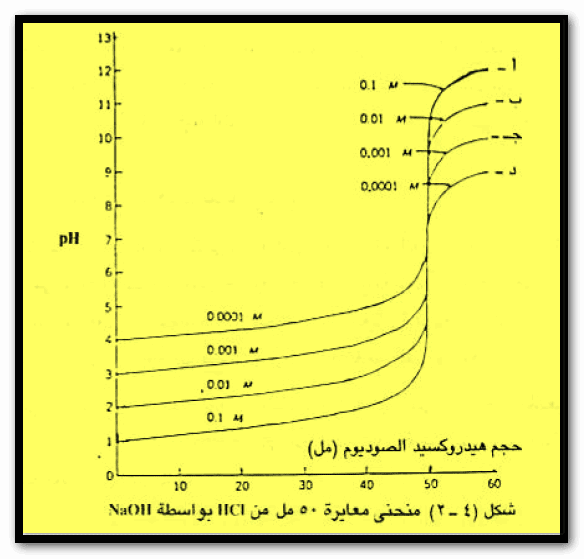
ملاحظات على منحنى معايرة حمض قوي مع قاعدة قوية
– واضح من منحنى المعايرة أن نقطة التكافؤ يمكن الاستدلال عليها بالتغير الكبير فى الرقم الهيدروجيني للمحلول.
– فإضافة 0.02 ملمن هيدروكسيد الصوديوم في مجال نقطة التكافؤ تسبب ارتفاع الرقم الهيدروجيني من 5 إلى 9 وهو ما يقابل تغير قي تركيز أيونات الهيدروجين مقداره عشرة آلاف مرة.
– تستعمل عادة في المعايرات محاليل قياسية تراكيزها بحدود 0.1 – 0.05N لذا فإن نقطة واحدة فقط من المحلول المعاير تسبب تغيراً كبيراً في الرقم الهيدروجيني قرب نقطة التكافؤ .
– أما في حالة استخدام محاليل تراكيزها أقل مثل 0.01 – 0.001N فإن شكل منحني المعايرة يتغير بحيث يصبح المدى الذي يتغير فيه الرقم الهيدروجيني تغيراً سريعاً أقل من المدى في التركيزات الأعلى كما هو موضح بالمنحنيات ب ، ج ، د في الشكل السابق.
– واضح من منحنى المعايرة أن المدى الواسع للرقم الهيدروجيني من منطقة التكافؤ يمكننا من استخدام العديد من الأدلة لتحديد نقطة التكافؤ مثل دليل الميثيل البرتقالي أو البروموثيمول الأزرق أو الفينولفثالين.
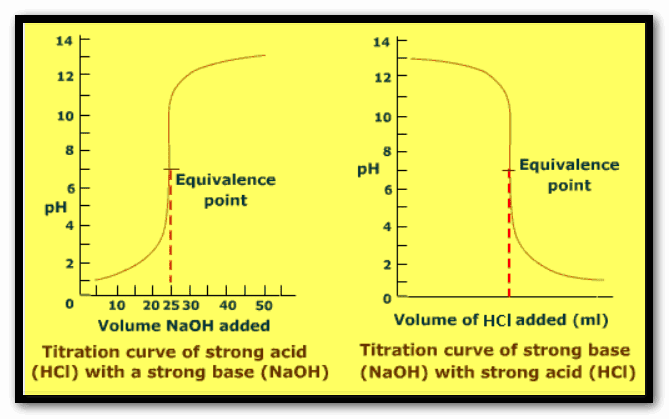
– عند معايرة قاعدة قوية بحمض قوي يمكن حساب الرقم الهيدروجيني في مراحل المعايرة المختلفة بنفس الطريقة إلا أنه يحسب تركيز أيون الهيدروكسيل المتبقي قبل نقطة التكافؤ كما بالشكل التالي:
– على ذلك يمكننا رسم العلاقات الآتية للتوضيح كما يلي:
– يمكننا إستنتاج جميع القوانين السابقة وتلخصيها فى الجدول الآتي كما يلي:
المراجع: التحليل الكيميائي الكمي التقليدي لطلاب الكليات والجامعات. محمد أحمد آشي – عبد الغني حمزة – توفيق عميرة – عبد العزيز السباعي – أحمد عشي ، الطبعة الثالثة (1418هـ – 1997 م ) – جامعة الملك عبد العزيز- المملكة العربية السعودية