أساسيات التحليل الحجمي Volumetric analysis
التحليل الحجمى بالمعايرة Titrimetric
– المعايرة من أهم العمليات المعملية أثناء التحليل الحجمي للمركبات.
– المعايرة عملية سريعة تعتمد أساساً على قياس حجم المحلول القياسي المستخدم أو تحديده.
– ومن معرفة هذا الحجم أو تحديده وحجم المحلول القياسي المستعمل بالضبط وتركيزه يصبح بالإمكان حساب وزن المادة أو النموذج بمساعدة القوانين الكيميائية.
– تتم عملية المعايرة بأن يُضاف أحد المحلولين من أنبوب مدرج يسمى السحاحة إلى دورق صغير يحتوي على حجم معين ومقاس بدقة باستعمال الماصة Pipette من محلول المادة الأخرى وتستمر هذه الإضافة – المعايرة Titration – حتى إتمام التفاعل بينهما.
شروط عملية التحليل الحجمي
من أهم شروط التحليل الحجمي الشروط الآتية كما يلي:
(1) يجب أن تمثل العملية تفاعلاً بسيطاً يمكن أن يعبر عنه بمعادلة كيميائية متكافئة Stoichiometry or Equivalent proportion دون أن يكون هناك تفاعل جانبي بين الدليل والمادة المجهولة.
(2) يجب أن يحدث التفاعل ويجري بسرعة كبيرة وبعكسه فان عملية المعايرة ستستهلك وقتاً طويلاً. وما من شك فأن معظم التفاعلات الأيونية تحقق هذا الشرط.
(3) يجب أن يكون للتفاعل نقطة انتهاء واضحة – تغيير ملحوظ في بعض الصفات الفيزيائية أو الكيميائية للمحلول – أو أن يتوفر دليل يظهر هذه النقطة إظهاراً متميزاً نتيجة تغير لونه.
(4) أن يستمر التفاعل على نهايته.
الأدوات المستخدمة فى التحليل الحجمي
(1) الأدوات المعملية كما يلي:
- السحاحات Burettes والماصات Pipettes على اختلاف أحجامها
- دوارق القياس Measuring or Volumrtric flasks
- أسطوانات القياس المدرجة Measuring cylinders
– فضلاً عن عديد من الأدوات الأخرى اللازمة لإجراء التحليل الحجمي والوزني.
(2) الأدلة لمعرفة نقطة انتهاء التفاعل.
(3) المواد الكيميائية عالية النقاوة وتتصف بمميزات تؤهلها للاستخدام في تحضير المحاليل القياسية.
المحاليل القياسية Standard solutions
– المحاليل القياسية تعرف بأنها محاليل يحتوي الحجم المعين منها على وزن معين من المادة المذابة.
– وهكذا تكون هذه المحاليل ذات درجة تركيز معلومة ودقيقة بالضبط.
– تحضر المحاليل ذات التراكيز الثابتة كما يلي: بإذابة وزن مضبوط بدقة من مادة تكون على درجة عالية من النقاوة والثبات.
– كما تسمى بالمادة القياسية الأولية Primary standard substance في حجم معين لتعطي التركيز اللازم بالضبط.
شروط المادة القياسية الأولية
(1) ذات تركيب معروف، ويسهل الحصول عليها بدرجة عالية من النقاوة (99%) أو من السهل تنقيتها بعد الكشف أو معرفة الشوائب التى تنبغي أن تتجاوز 0.2% كما يسهل تجفيفها (100 -120 Co) وحفظها في حالة نقية. ومن الصعب أن تتوفر هذه المميزات في المواد المائية.
(2) أن تكون المادة غير متميعة Non hydroscopic كما يجب ان لا تكون قابلة لأي تغير فيها في أثناء عملية الوزن.
(3) يجب أن يكون وزنها المكافئ كبيراً حتى تصبح أخطاء الوزن في حدود الإهمال.
(4) كما يجب أن تكون المادة سهلة الذوبان في الماء تحت الظروف التي تستعمل فيها.
(5) أن يكون التفاعل مع المادة القياسية من التفاعلات التي تظهر تماماً عند نقطة التكافؤ وأن يتم بسرعة.
(6) يجب أن لا يكون محلول المادة القياسية الأولية ملوناً قبل انتهاء عملية المعايرة أو بعدها منعاً لتداخل لونها مع لون الدليل المستعمل لإيجاد نقطة انتهاء التفاعل.
(7) علاوة على ذلك يجب أن لا تتأثر بالضوء ودرجات الحرارة والغبار والمواد العضوية.
المواد القياسية المستخدمة فى التحليل الحجمي
(1) في حالة تفاعلات التعادل
من المواد القياسية المستخدمة فى حالة تفاعلات التعادل أثناء التحليل الحجمي هى كما يلي:
- كربونات الصوديوم Na2CO3
- البوراكس Na2b4O7.10H2O
- فثالات البوتاسيوم الحامضية C8H5O4K
- حمض الهيدروكلوريكHCl
- يوديدات البوتاسيوم الحامضية KHIO3
- حمض السكسنيكH2C4H4O4
- حمض البنزويكC6H5COOH
- حمض الفورميكCH2O2
- حمض الأوكزاليك H2C2O4
(2) في حالة تفاعلات الأكسدة والاختزال
من المواد القياسية المستخدمة فى حالة تفاعلات الأكسدة والاختزال أثناء التحليل الحجمي هى كما يلي:
- ثنائي كرومات البوتاسيوم K2Cr2O7
- برومات البوتاسيوم KBrO3
- أيودات البوتاسيومKIO3
- أيودات البوتاسيوم الحمضية KHIO3
- اليود I2
- أوكزالات الصوديوم Na2C2O4.
(3) في حالة تفاعلات الترسيب
من المواد القياسية المستخدمة فى حالة تفاعلات الترسيب أثناء التحليل الحجمي هى كما يلي:
- الفضةAg
- نترات الفضةAgNO3
- نترات الزئبقيك HgNO3
- كلوريد البوتاسيوم.
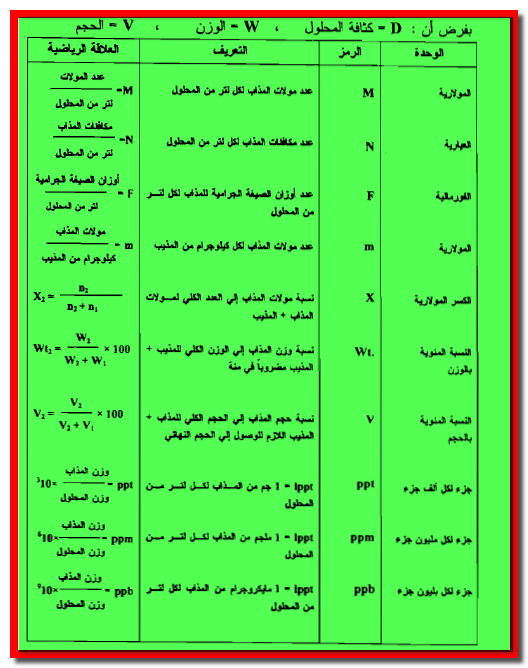
القوانين المستخدمة في التحليل الحجمي
– تقدر كتلة المادة عادة بالوحدات المترية كما يلي:
- الكيلو جرام(Kg)
- الجرام (g)
- الميلجرام(Mg)
- والميكروجرام(μg)
- النانوجرام(ng)
- البيكوجرام(Pg)
والعلاقة بين هذه الوحدات هي كما يلي:
– غير أننا لأغراض الحسابات الكيميائية نفضل استخدام الوحدات التى تعبر عن العلاقات الوزنية أو نسب الاتحاد الكيميائية بين المواد المتفاعلة بدلالة أعداد صحيحة صغيرة.
– لهذا السبب تستعمل كل من المفاهيم الآتية كما يلي:
- المولاريةMolarity
- العيارية Normality
بوصفها وحدات للتركيز في الحسابات الحجمية.
– استخدام المكافئات والأوزان المكافئةEquivalent weights ، بدلاً من المولات وأوزان الصيغةFormula weights
– الجدول التالي يوضح القوانين المستخدمة في التحليل الحجمي كما يلي:
المراجع: الباب الرابع / أساسيات التحليل الحجمي Principles of Volumetric analysis من كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي ) للمؤلف / محمد مجدي عبدالله واصل.








