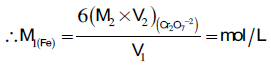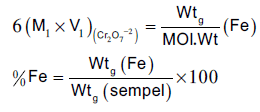تحليل عينة من خام الحديد بواسطة محلول قياسي من ثاني كرومات البوتاسيوم
تجربة تحليل عينة من خام الحديد بواسطة K2Cr2O7
– تحليل عينة من خام الحديد وتقدير النسبة المئوية للحديد في هذه العينة بواسطة محلول قياسي من ثاني كرومات البوتاسيوم 0.025 mol/L
Determination of iron in an ore sample by potassium dichromate
الهدف من تجربة تحليل عينة من خام الحديد بواسطة K2Cr2O7
– هذه التجربة هي أحدى تطبيقات معايرات الأكسدة والاختزال.
– تعيین مولاریة وتركیز الحدید في خاماته أو في محلول عینة ما تحوي الحدید وذلك عن طریق المعایرة بواسطة محلول قياسي من ثاني كرومات البوتاسيوم 0.025 mol/L
– تحتوي خامات الحدید بصورة عامة على أشكال عدیدة من الحدید بعضها یحتوي على :
Fe3O4 & Fe2O3 & FeO & FeSiO3 & FeS & FeCO3
وهي أكسید الحدیدوز، أكسید الحدیدیك ، أكسید الحدید المغناطیسي كربونات الحدیدوز، كبریتید الحدید ، سلكات الحدیدیوز.
– عند تحلیل عینة من خام الحديد تتم عملیة التحلیل كالآتي:
- یتم إذابة خام الحديد.
- اختزال الحدیدیك إلى حدیدیوز وذلك باستخدام عامل مختزل .
- یتم التخلص من زیادة العامل المختزل .
- تجري عملیة المعایرة مع المحلول القیاسي المستخدم
المواد الكيميائية المستخدمة في تجربة تحليل عينة من خام الحديد بواسطة K2Cr2O7
(1) محلول خام الحديد
- یتم تجهیزه بسحق الخام إلى مسحوق ناعم كما یجب حرقه في بوثقة حرق لمدة عشرة دقائق وذلك للتخلص من المواد العضویة.
- ثم یذاب مسحوق الخام في حمض الهیدروكلوریك وتزداد سهولة الذوبان بإضافة قلیل من كلورید القصدیروز.
- ثم یرشح المحلول نظراً لوجود بعض السلیكات غیر الذائبة التي یتم صهرها بعد الترشیح مع كربونات الصودیوم لیتكون ناتج له قابلیة الذوبان في الحمض كما في المعادلة الآتية:
FeSiO3 + Na2CO3 → FeCO3 + Na2SiO3
(2) حمض الهیدروكلوریك (1:1)
(3) محلول كلورید القصدیروز الذي یحضر بإذابة 15 جم من (SnCl22H2O) في 100 مل من حمض الهيدروكلوريك.
(4) محلول كلورید الزئبقیك المشبع
(5) حمض الكبریتیك المخفف (5:1)
(6) حمض الفوسفوریك (85%)
(7) محلول قياسي من ثانى كرومات البوتاسيوم 0.025 mol/L
(8) محلول دلیل ثنائي فینیل الأمین الذي یحضر بإذابة 1 جم من الدلیل في 100 مل حمض الكبریتیك المركز
(9) ماء مقطر
الأدوات المستخدمة
- بوتقة حرق
- قمع ترشيح
- ورق ترشيح
- مجفف
- زجاجة ساعة
- سخان كهربائي
- قطارة
- أسطوانة مرجة أو ماصة آلية
- سحاحة وحامل السحاحة
- ماصة قیاسیة
- دورق مخروطي 400 مل
- عدة كاسات سعة 400 مل
- ساق زجاجیة
معادلات التفاعل
Cr2O7-2 + 14H+ + 6e– ↔ 2Cr+3 + 7H2O
6Fe+2 ↔ 6Fe+3 + e–
Cr2O7-2 + 14H+ + 6Fe+2 ↔ 2Cr+3 + 6Fe+3 + 7H2O
K2Cr2O7 + 7H2SO4+ 6FeSO4 → K2SO4 + Cr2(SO4)3 + 7H2O + 3Fe2(SO4)3
خطوات تجربة تحليل عينة من خام الحديد بواسطة K2Cr2O7
(1) تجهيز محلول العینة
يتم تجهيز محلول العینة المجهولة من خام الحديد كالآتي:
– سخن (3 جم) من خام الحديد لمدة ساعة عند درجة حرارة 110 Co ثم برده في مجفف.
– زن بدقة وزنه مقداره (0.35 جم) من الخام المجفف وأنقله إلى كأس سعة 400 مل ، ثم أضف إلیه 30 مل حمض الهیدروكلوریك (1:1).
– غطي الكأس بزجاجة ساعة وسخن محتويات الكأس إلى قرب درجة الغلیان لمدة تتراوح ما بين (45-60)دقيقة.
– اترك الكأس بمحتوياته لمدة نصف ساعة على صفيحة ساخنة (سخان كهربائي على أقل درجة حرارة) حتى یذوب كل الخام الموجود في الكأس (أي حتى تختفي كل المادة الداكنة وتتحول إلى مادة صلبة عديمة اللون).
– رشح محتويات الكأس وأغسل قعر زجاجة الساعة بالماء المقطر داخل قمع على الدورق القیاسي ثم أغسل القمع وأكمل الحجم إلى 250 مل بالماء المقطر حتى العلامة ورج المحلول للتجانس.
باقي خطوات التجربة
(2) خذ 50 مل من محلول خام السابق التحضیر في دورق مخرو طي سعة 400 مل ثم أضف إلیه 5 مل من حمض الهیدروكلوریك المركز ثم سخن إلى قرب درجة الغلیان.
(3) بواسطة قطارة أضف قطرات متعاقبة من كلورید القصدیروز الحدیث التحضیر الذي یعمل على اختزال كل أیونات الحدیدیك في عینة الخام إلى أیون حدیدوز (أي حتى یختفي لون أیون الحدیدیك المصفر) ثم أضف زیادة قطرة أو قطرتین من كلورید القصدیروز.
(4) برد المحلول باستخدام ماء الصنبور ، وأضف بسرعة 10 مل من محلول كلورید الزئبقیك المشبع مع ملاحظة أن هذا المحلول (سام جدا) لهذا یضاف من أسطوانة مرجة أو بواسطة ماصة آلیة ولا یتم إضافته بالماصة العادیة لأي سبب .
ملاحظة: یجب ملاحظة تكون راسب أبیض حریري بكمیات صغیرة عند إضافة كلورید الزئبقوز المشبع وهذا الراسب هو ناتج التفاعل التالي:
2HgCl2 + Sn+2 ↔ Hg2Cl2 + Sn+4 + 2Cl
وإ ذا حدث ولم یتكون راسب رمادي أو أسود فیجب إهمال هذا المحلول وحدفه والبدء بالعمل على محلول جدید.
(5) أضف إلى الدورق المخروطي ( 200 مل) ماء مقطر و( 10 مل) حمض الكبریتیك مخفف (5:1) ، و (5 مل) من حمض الفوسفوریك المركز، حیث یعمل حمض الفوسفوریك وحمض الكبریتیك على وضوح لون الدلیل عند نقطة التكافؤ.
(6) أضف 6 قطرات من دلیل ثنائي فینیل الأمین.
(7) إبدأ عملیة المعایرة بتنقیط محلول ثنائي كرومات البوتاسیوم القیاسي (0.025 mol/L ) قطرة قطرة مع الرج المستمر حتى یتغیر لون المحلول عند نقطة التكافؤ إلى اللون البنفسجي المزرق.
(8) سجل الحجم المستهلك من السحاحة K2Cr2O7 .
(9) كرر التجربة ثلاثة مرات ثم أحسب متوسط الحجم المستهلك.
الحسابات
– من معادلة التفاعل الموزونة كما يلي:
Cr2O7-2 + 14H+ + 6Fe+2 ↔ 2Cr+3 + 6Fe+3 + 7H2O
نجد أن:
1mol K2Cr2O7 = 6mol Fe+2
– عدد مللي مولات الحديدوز = عدد مللي مولات ثاني كرومات البوتاسيوم
(K2Cr2O7) M2 × V2 = M1 × V1 (Fe+2)
– لكي يتم تكافؤ عدد مللي مولات سيتم ضرب مللي مولات الكرومات × 6 ، وضرب مللى مولات الحديدوز × 1 ويكون:
(K2Cr2O7) 6 (M2 × V2) = 1(M1 × V1) (Fe+2)
:وبالتالي فإن المولارية تعين من العلاقة كما يلي
حساب النسبة المئوية للحدید
لحساب النسبة المئوية للحدید في عینة الخام المدروسة نستخدم العلاقات كما يلي:
عدد مللي مولات الحدید = عدد مللي مولات ثاني كرومات البوتاسیوم
المراجع: – كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها