المحاليل المنظمة Buffer Solutions
تعريف المحلول المنظم Buffer Solution
– المحاليل المنظمة هي المحاليل التي تقاوم التغير في الرقم الهيدروجيني عند إضافة كميات قليلة من الأحماض أو القواعد القوية أو عند تخفيفها.
– وهي عبارة عن محلول لحمض ضعيف وأحد أملاحه أو قاعدة ضعيفة وأحد أملاحها.
الأهمية البيولوجية للمحاليل المنظمة
– المحاليل المنظمـة لها أهمية كبيرة في الأنظمة الكيميائية والبيولوجية بحيث تتميز السوائل الحيوية برقم هيدروجيني ثابت.
– ففي جسم الإنسان تختلف قيمة الـ pH من سائل إلى آخر فمثلا في الدم تبلغ 7.4 بينما في العصارة المعدية تبلغ 1.5
– هذه القيم تعتبر مناسبة ومثالية لعمل الإنزيمات وموازنة الضغط الأسموزي.
– هذه القيم يُحافظ عليها غالباً عن طريق المحاليل المنظمـة.
– أهم المحاليل المنظمة هي الفوسفات والبيكربونات.
العلاقات الرياضية للمحاليل المنظمة
– وضع العالمان Henderson-Hasselbalch المعادلة الأساسية التي توضح العلاقة بين الرقم الهيدروجينى pH ونسبة الحمض والقاعدة المقترنة.
– وهذه المعادلة لها أهميتها في فهم عمل وتحضير المحاليل المنظمة.
– لنفرض أنه يوجد لدينا محلولا من الحمض الضعيف HA فإن هذا يتفكك لدى إذابته في الماء حسب المعادلة كما يلي:
– ويمكن استخدام المعادلة في حساب الرقم الهيدروجيني إذا عرفت نسبة الحمض إلى القاعدة المقترنة و pK للحمض.
– من المعادلة السابقة نجد أن الرقم الهيدروجيني للمحلول المنظم يعتمد على عاملين كما يلي:
- قيمة pK
- النسبة بين تركيز الحمض والقاعدة المقترنة
سعة المحلول المنظم أو كفاءته ( Buffer Solution Capacity)
– تعبر عن مدى مقاومة المحلول المنظم للتغير في الرقم الهيدروجيني، وتكون أكبر ما يمكن عندما تكون النسبة بين الحمض والقاعدة المقترنة مساوية للواحد.
– من الأمثلة : حمض الخليك (acetic acid CH3COOH) كحمض ضعيف وقاعدته المقترنة هي خلات الصوديوم (sodium acetate CH3COONa)
قوانين pH للمحاليل المنظمة
(1) إذا كان الحمض ضعيف وملحه:
حيث : ثابت التأين الحامضpKa =
(2) إذا كان القاعدة ضعيفة وملحها:
حيث : ثابت تفكك القاعدة =pKb
كيف تعمل المحاليل المنظمة ؟
الحالة الأولى/ دراسة أثر إضافة حمض HCl إلى المحلول المنظم
- إضافة HCl يعني إضافة +H وبالتالي زيادة تركيز +H3O في المحلول فيختل الاتزان.
- وفقاً لمبدأ لوتشاتلييه سينزاح التفاعل (1) نحو اليسار بتفاعل +H3O الزائدة مع –CH3COO
- نتيجة انزياح التفاعل (1) نحو اليسار سيزول تقريباً أثر الزيادة في تركيز +H3O الناتجة من إضافة الحمض HCl وبالتالي تبقى قيمة pH للمحلول ثابتة تقريباً.
الحالة الثانية/ دراسة أثر إضافة قاعدة NaOH إلى المحلول المنظم
- إضافة قاعدة NaOH يعني إضافة OH– والتي تتفاعل مع +H3O في المحلول فيختل الاتزان.
- وفقاً لمبدأ لوتشاتلييه سينزاح التفاعل (1) نحو اليمين بتفكك المزيد من CH3COOH فيتم تعويض النقص في +H3O فيبقى تركيزها ثابتاً تقريباً ، وبالتالي تبقى قيمة pH للمحلول ثابتة تقريباً.
أهمية المحاليل المنظمة
– يتطلب الكثير من العمليات الكيمائية والحيوية أن لا تتغير قيمة pH لوسط التفاعل كثيراً بل تبقى قريبة من قيمة معينة.
– ومثال ذلك أن الدم في جسم الإنسان لا يمكن أن يقوم بوظيفة نقل الأكسجين إلى الخلايا إلاّ أن تكون قيمة pH = 7.4
– للمحاليل المنظمة أهمية كبيرة كما يلي:
- أن الأنزيمات تحتاج لوسط تكون فيه قيمة pH ثابتة تقريباً لتعمل بنشاط.
- معالجة التربة لنمو المحاصيل المختلفة.
- معايرة جهاز قياس الأس الهيدروجيني.
موضوعات ذات صلة بالمحاليـل المنظمة:



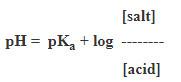
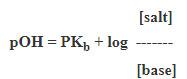






ماهي أهمية المحلول المنظم في الكيمياء الحيوية
????
أن الأنزيمات تحتاج لوسط تكون فيه قيمة pH ثابتة تقريباً لتعمل بنشاط
ماهو ال pk
أيضا هل يعتبر الدم محلول منظم،؟