رسم منحنى المعايرة لتفاعل حمض ضعيف مع قاعدة قوية
في هذا الموضوع سيتم مناقشة كيفية رسم منحنى المعايرة لتفاعل حمض ضعيف مع قاعدة قوية
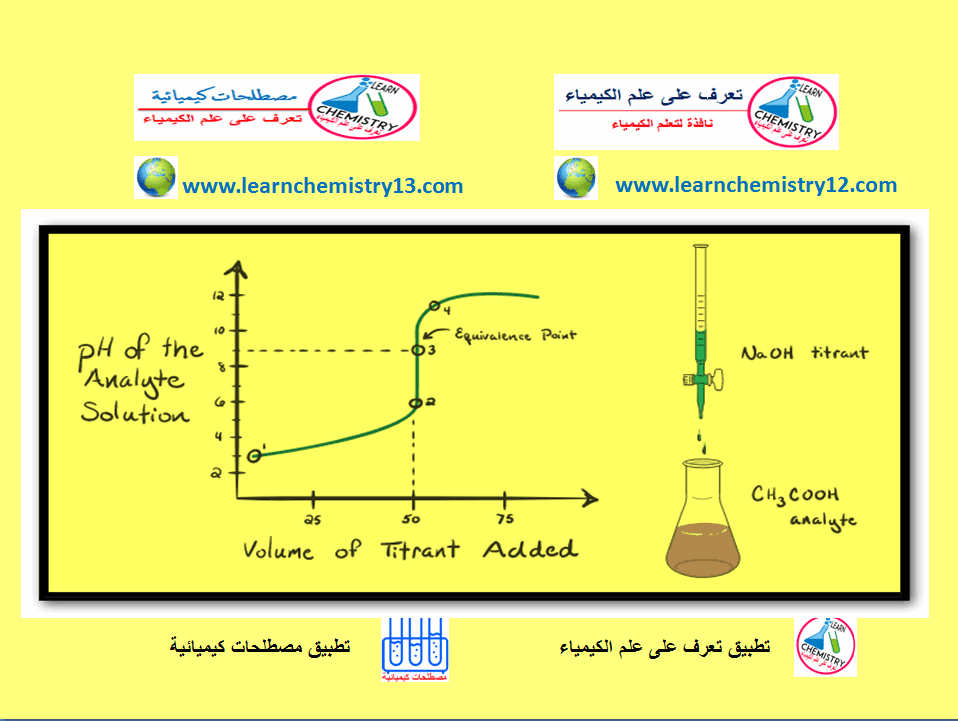
Titration Curve of a weak acid with a strong base
منحنى المعايرة
– هو المنحنى الذي يمثل العلاقة بين حجم الحامض المتعادل (أو حجم القاعدة التي تعادل أجزاء مختلفة من القاعدة) والرقم الهيدروجيني للمحلول.
– ويمثل التغير في الرقم الهيدروجيني في المنطقة المجاورة لنقطة التعادل أهمية كبيرة في اختيار الدليل المناسب الذي يعطي أقل خطأ في المعايرة. ويعتمد المنحنى على نوع الحامض ونوع القاعدة والتركيز.
وسوف نتطرق بالتفصيل لدراسة وكيفية رسم منحنيات المعايرة لمختلف أنواع تفاعلات الأحماض مع القواعد وذلك عن طريق الحسابات النظرية للرقم الهيدروجيني
منحنيات المعايرة ( أضغط على المعايرة التي تريدها لقراءة الموضوع )
1- منحنى معايرة حمض قوي مع قاعدة قوية
( Titration of strong acid with strong base)
2- منحنى معايرة حمض ضعيف مع قاعدة قوية
( Titration of weak acid with strong base)
3- منحنى معايرة قاعدة ضعيفة مع حمض قوي
( Titration of strong acid with weak base)
4- منحنى معايرة حمض ضعيف مع قاعدة ضعيفة
( Titration of weak acid with weak base)
ولكن خلال هذا الدرس سوف نشرح فقط كيفية استنتاج منحنى معايرة تفاعل حمض ضعيف مع قاعدة قوية وأن شاء الله سوف نستكمل باقي المنحنيات في الدروس القادمة.
منحنى المعايرة لتفاعل حمض ضعيف مع قاعدة قوية
– لا يكون مدي التغير الكبير والمفاجئ في الرقم الهيدروجيني عند نقطة التكافؤ في حالة معايرة حمض ضعيف بقاعدة قوية بنفس قيمة التغير عند معايرة حمض قوي بقاعدة قوية.
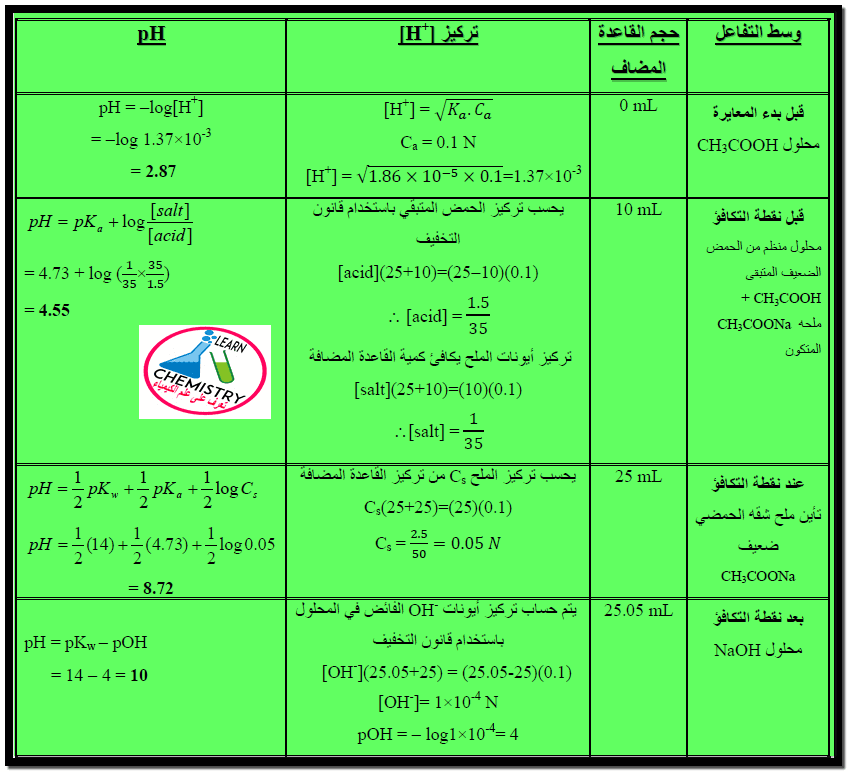
– ولرسم منحنى المعايرة في هذه الحالة لابد من حساب الرقم الهيدروجيني في أربع مناطق مميزة من المنحنى وهي:
(1) في البداية أي قبل بدء المعايرة ويحتوي المحلول على الحمض الضعيف فقط ويحسب الرقم الهيدروجيني في هذه الحالة من التركيز العياري للحامض ومن ثابت تأينه.
(2) بعد الإضافات المتتالية من القاعدة وقبل نقطة التكافؤ . وفي هذه الحالة يتكون المحلول من سلسلة من المحاليل المنظمة (buffers) ويحسب الرقم الهيدروجيني من تركيز الملح الناتج وكمية الحامض المتبقية.
(3) عند نقطة التكافؤ: يحتوي المحلول على القاعدة المرافقة للحامض (conjugate base) أو الملح ويحسب الرقم الهيدروجيني للمحلول من التركيز العياري للملح ومدي تميؤه الذي يدل عليه ثابت تأين الحمض الضعيف.
(4) بعد نقطة التكافؤ: في هذه الحالة تحد الكمية الفائضة من القاعدة القوية المستعملة كمحلول معاير من تميؤ الملح الناتج ويكون المسئول الرئيسي عن التغير فى الرقم الهيدروجيني هو تركيز ايونات الهيدروكسيل الناتجة عن تأين القاعدة القوية الفائضة من التفاعل.
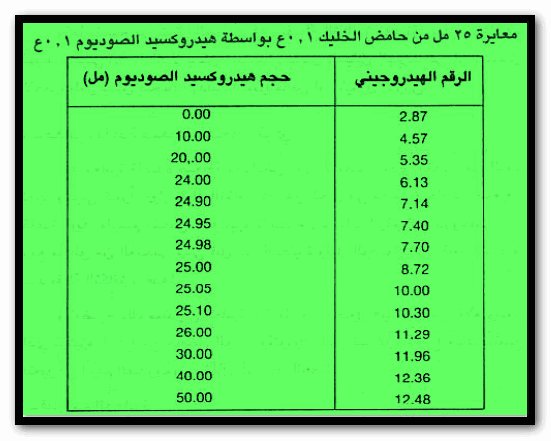
ويمكن تمثيل معايرة حمض ضعيف مع قاعدة قوية بدراسة معايرة 25 مل من حمض الخليك 0.1N بواسطة محلول هيدروكسيد الصوديوم 0.1N علماً بأن ثابت التأين لحمض الخليك:
Ka = 1.86 × 10-5 , pKa = – log Ka = 4.73
وسوف نتتبع التغير الذي يحدث فى الرقم الهيدروجيني للمحلول خلال المراحل الأربعة السابق ذكرها لنتمكن من رسم منحنى المعايرة.
أولاً/ قبل بداية التفاعل
قبل إضافة هيدروكسيد الصوديوم يتأين حمض الخليك تأيناً جزئياً حسب المعادلة:
وبتطبيق قانون فعل الكتلة على هذا الاتزان فإن :
Ka= [H+] [CH3COO–] / [CH3COOH]
وحيث أن تركيز ايون الهيدروجين الناتج عن تأين الماء صغير مقارنة بتركيز ايون الهيدروجين الناتج عن الحمض فأنه يمكن اعتبار:
[H+] = [CH3COO–]
كما يمكن اعتبار تركيز حمض الخليك مساوياً 0.1 N لأن الكمية المتأينة من الحمض صغيرة جداً. وعلى ذلك يكون:
[H+]2 = Ka [CH3COOH]
[H+]2 = 1.86× 10-5 × 0.1
= [H+] = 1.37× 10-5 mol/L
– log [H+] = – log 1.37× 10-5
= 2.87 pH
ثانياً/ قبل نقطة التكافؤ
يتكون في هذه الحالة محلول منظم من حمض الخليك المتبقي ومن خلات الصوديوم الناتجة. فمثلاً بعد إضافة 10 مل من هيدروكسيد الصوديوم. يحسب الرقم الهيدروجيني كالتالي:
[H+] = Ka [CH3COOH]/[CH3COO–]
pH = pKa + log [salt]/[acid]
وحيث يمكن اعتبار تركيز أيون الخلات مساوياً لتركيز خلات الصوديوم المتكونة والتي تكافئ كمية هيدروكسيد الصوديوم المضافة أي ان:
[salt] = [CH3COO–]
×0.1) / (25+10)= (10
/35 mol/L = 1
ويكون تركيز حمض الخليك المتبقي هو:
[acid] = [CH3COOH]
(25×0.1) – (10×0.1) / (25+10)=
/35 mol/L = 1.5
وبالتعويض عن هذه القيم في معادلة pH أعلاه نجد أن:
× 35/1.5)pH = 4.74 + log (1/35
pH = 4.55
وبنفس الطريقة يمكن حساب الرقم الهيدروجيني للمحلول بعد كل إضافة من المحلول المعاير إلى ما قبل نقطة التكافؤ.
ثالثاً/ عند نقطة التكافؤ
أي عند إضافة 25 مل من محلول هيدروكسيد الصوديوم. في هذه الحالة يكون في المحلول الملح الناتج عن التفاعل والذي يعتبر القاعدة المرافقة للحمض والذي يتميه جزئياً حسب التالي:
ويحسب الرقم الهيدروجيني للمحلول من علاقة تميه الأملاح التي شقها الحامضي ضعيف وهي:
pH = 1/2 pKw + 1/2 pKa + 1/2 log C
حيث C تركيز الملح والذي يمكن اعتباره في هذه الحالة مساوياً لتركيز أيون الخلات الناتجة عند نقطة التكافؤ
[salt] = [CH3COO–]
(25×0.1) / (25+25)=
0.05 mol/L =
وبالتعويض في العلاقة السابقة يكون الرقم الهيدروجيني للمحلول:
pH = 8.72
رابعاً/ بعد نقطة التكافؤ
– أن إضافة زيادة من القاعدة يحد من تركيز أيونات الهيدروكسيل الناتجة من تميؤ الملح . وبذلك يمكن حساب الرقم الهيدروجيني للمحلول من تركيز أيونات الهيدروكسيل الفائضة عن التفاعل.
– فمثلاً عند إضافة 25.05 مل من محلول هيدروكسيد الصوديوم فإن تركيز أيونات الهيدروكسيل الفائضة عن التفاعل يكون:
[OH–] = (25.05×0.1 – 25×0.1) / (25+25.05)
= 1 × 10-4
– log [OH–] = – log 1 × 10-4
= 4 pOH
pH = 14 – pOH = 14 – 4 = 10
والجدول التالي يبين التغير فى الرقم الهيدروجيني خلال معايرة 25 مل من حمض الخليك 0.1 N بواسطة هيدروكسيد الصوديوم 0.1 N
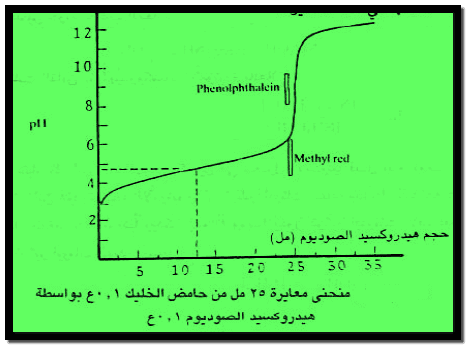
كما يبين الشكل التالي منحنى المعايرة السابقة والأدلة التي يمكن استخدامها في هذه المعايرة.
وكما يتضح من شكل المنحنى فإن نقطة التكافؤ تقع تقريباً عند الرقم الهيدروجيني pH = 8.7 ولذلك لا يمكن استخدام دليل الميثيل البرتقالي أو الميثيل الأحمر ولكن يمكن استخدام دليل الفينولفثالين أو الثيمول الأزرق.
ويمكن تلخيص القوانين السابقة بالجدول التالي:



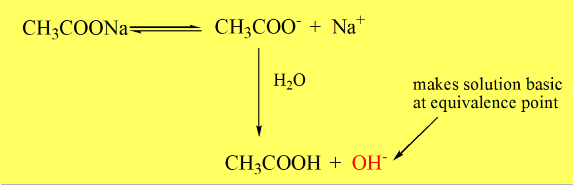





لماذا لايمكن استعمال المثيل الاحمر اوالمثيل البرتقالي في عملية تسحيح حامض الخليك