طرق حساب عدد المولات (المول) + مسائل محلولة

المول The Mole
عدد أفوجادرو (NA)
ونظراً لأنه یصعب حساب الوزن الذري لذرة واحدة وذلك لصغرھا، لذلك فمن المناسب أن نضخم الكمیة حتى یمكن أن نتعامل معھا وذلك بأخذ مول من الذرات أو الجزیئات أي عدد أفوجادرو من الذرات أو الجزیئات.
أمثلة توضيحية
وقد وجد عملياً أن وزن المول بالجرامات يساوي الوزن الذري من الذرات، ويساوي الوزن الجزيئي من المركبات عددياً.
الكتلة المولية Molar Mass
ھي كتلة مول واحد من الذرات أو الجزیئات أو الأیونات، ووحدتھاg/mol
وإذا كان المراد حسابه ھو الوزن الجزیئي لمول من الجزیئات فإن له الوزن بوحدة (amu) إلا أن وحدة الوزن حینئذ هي g/mol بدلاً من (amu) ویطلق على الوزن حینئذ بالكتلة المولیة) الوزن المولي).
مثال (1) : أحسب الوزن الجزيئي MW لمول واحد من الجزئيات التالية بوحدة g/mol
N2, NO, C2H6, N2O4, C8H18O4N2S, CO2, H2O2, Ca(NO3)2, Al2(CO3)3 , MgSO4.7H2O, C8H10N4O2, C6H12O6, H2SO4, C2H5OH, Zn(NO3)2
علماً بأن الأوزان الذریة:
(H = 1, C = 12, N = 14, O = 16, Mg = 24.3, Al = 27, S = 32.1, Ca = 40.1, Zn = 65.4)
الحل :
وبالنسبة لمول من الذرات الأحادية مثل (K, Ar, Ne, Al, Fe,…..) فإن الوزن لمول منها يطلق عليه الوزن الذري ورمزه Aw
مثال (2) : احسب عدد الذرات (K, S, O) الموجودة فى مول واحد من K2SO4 ؟
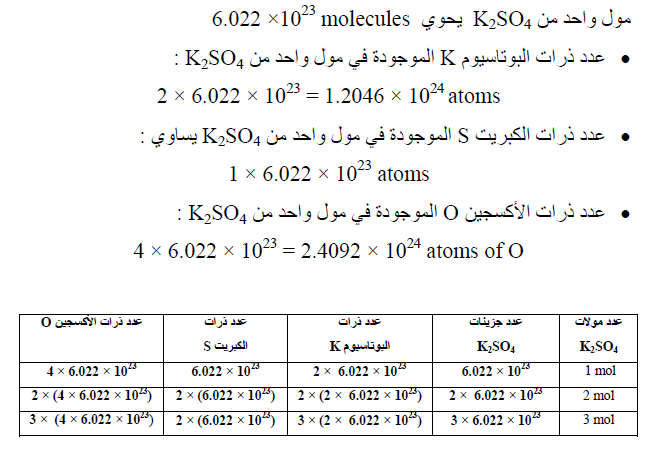
طرق حساب عدد المولات



مسائل محلولة
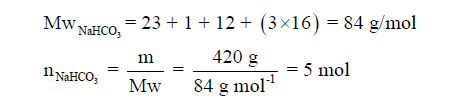
مثال (4): أحسب عدد مولات (1500 molecules) من سكر السكروز C11H22O11 ؟
الحل:
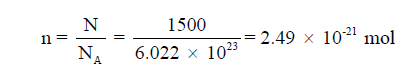
الحل:
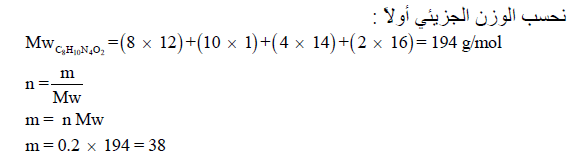
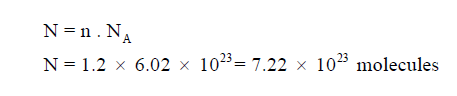
مثال (7) : كم عدد جزئيات 18 g من سكر الجلوكوز C6H12O6 ؟
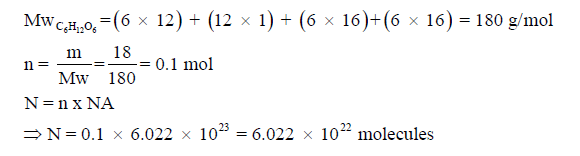
مثال (8) : ما عدد مولات 48 g مما يلي:

الحل:

الحل :




في حالة رغبتك في أمثلة وتمارين أكثر قم بزيارة هذا الرابط: شرح القوانين المستخدمة فى حساب عدد المولات؟
المراجع : المول The Mole – الفصل الأول / طرق التعبير عن التركيز من كتاب أسس الكيمياء العامة والفيزيائية للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء كلية العلوم -جامعة أم القري.

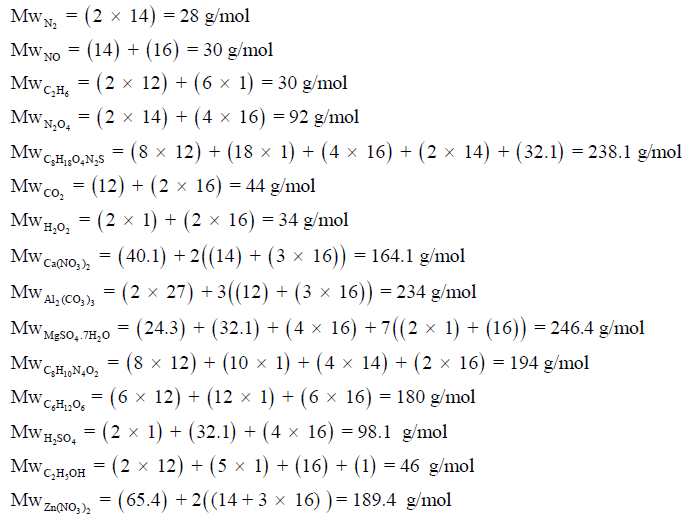






أن شاء الله بالتوفيق
نأمل أن تكون أستفدت من الموضوع
شكراً لك
حلو
هذا أفضل واروع موقع رايتة في حياتي
شكراً لك مرورك وتعليقك الاروع
شكرا
شكرا
كيف يمكن حساب عدد مولات NH3 الازمة لانتاج 2.5 مول من Cu(NH3)4SO4
تسلموا
كم نحن بحاجة لمثل هذه المواقع العلمية الهادفة في عالمنا العربي، شكرا على كل ما تقدموه من محتوى قيم و غني..
متمنياتنا لكم بمزيد من التألق و الازدهار