المولارية Molarity + مسائل محلولة
تعريف المولارية Molarity
– المولارية هي أحدى طرق التعبير عن التركيز ويرمز لها بالرمز M وبالإنجليزية Molarity
– وتعرف المولاريــة بعدد المولات المذابة في لتر واحد من المحلول.
– معملياً تحضر المحاليل المولاريــة باستخدام الدوارق الحجمية وذلك بأخذ الكمية المناسبة من المادة المذابة ووضعها في الدورق الحجمي ، ثم إضافة المذيب ( وعادة ما يكون الماء) مع الرج المستمر حتى يصل مستوى المحلول العلامة الدالة على الحجم .

وحدة قياس المولاریة Molarity
تقاس المولاريــة بالوحدات التالية:
- مولار (molar) وتختصر بالرمز (M)
- مول / لتر Mole/L
القانون الرياضي للمولارية Molarity
قوانين هامة ذات العلاقة بالمولارية
(1) العلاقة بين المولارية والنسبة المئوية الوزنية والكثافة لمحلول
تعطى كما بالعلاقة التالية:
(2) العلاقة بين المولارية والعيارية
تعطى كما بالعلاقة التالية:
أمثلة محلولة على المولارية
مثال (1): احسب مولاريـة محلول يتكون من إذابة 20 جرام هيدروكسيد الصوديوم في 500 سم3 من الماء ؟
الحل:

مثال (2): احسب مولارية حمض الكبريت (VI) المتكون من إذابة 49 جرام من الحمض في 100 سم3 من الماء ؟
الحل:
مثال (3): ما مولاريــة محلول يحتوى على 3mol من سكر الجلوكوز C6H12O6 مذاب فى كمية من الماء بحيث يصبح حجم المحلول 750ml؟
الحل:
مثال (4): أحسب التركيز بالمولاريــة mol/L لمحلول يحتوي على 20g من سكر القصب C12H22O11 مذاب فى 125g من الماء علماً بأن كثافة المحلول 1.02gm/ml
الأوزان الذرية (H = 1 , C = 12 , O =16)
الحل:
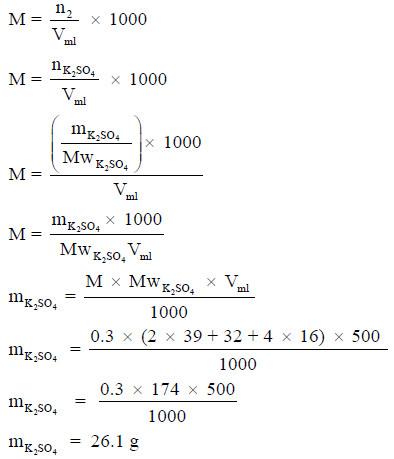
مثال (5): كمك جراماً من كبريتات البوتاسيوم K2SO4 تلزم لتحضير 500ml من محلول تركيزه 0.3M علماً بأن الكتل الذرية (O = 16 , S = 32 , K =39)
الحل:
مثال (6): احسب الحجم بالمللتر لمحلول تركيزه 0.12M ويحتوى على 0.00756mol من HClO4؟
الحل:
مثال (7): أحسب النسبة الوزنية لمحلول كبريتات البوتاسيوم K2SO4 الذي تركيزه 0.2M وكثافته 1.1g/cm3 الوزن الذري (O = 16 , S = 32 , K =39)
الحل:
يتم الحل كما يلي:
لمزيد من التمارين والأمثلة والعلاقات الرياضية المتعلقة بالمولاريــة: أضغط هنا أو تابع الفيديو التالي:



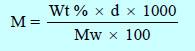

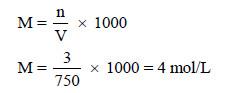
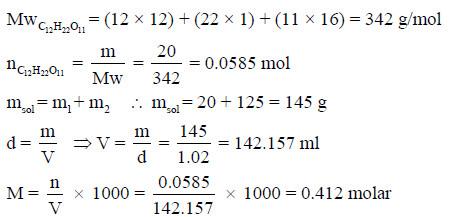
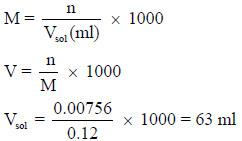
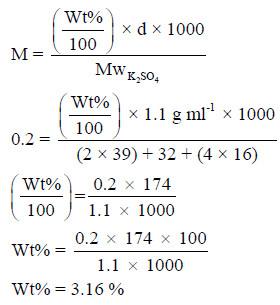





مجهود مشكور