المولالية Molality + مسائل محلولة

المولالية Molality ( التركيز الجزيئي الوزني )
المولالية ھي عدد مولات المادة المذابة في كیلوجرام من المذیب. والصيغة الرياضية لها كما يلي:
ووحدة المولالية هي مولال (molal) أو mol/kg ، حيث:-
m: المولالية ، ويرمز لها بحرف مائل تمييزاً لها عن رمز الكتلة (m)
n2: عدد مولات المذاب
m1: كتلة المذيب بوحدة الكيلو جرام.
والعلاقة بين الجرام والكيلوجرام هي : 1 kg = 1000 g
ویمكن استخدام وحدة الجرام في قانون المولالیة كما في العلاقة التالية:
مسائل محلولة على المولالية Molality
مثال (1): أحسب التركيز بالمولالية لمحلول تم تحضيره بإذابة (2 mol) من حمض الكلور في 800 g من الماء ؟
الحل:
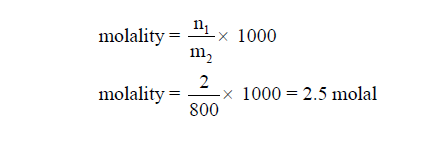
مثال (2): عند إذابة 20 g من كلوريد الصوديوم NaCl فى كمية من الماء بحيث تصبح كتلة المحلول 90 g . أحسب مولالية المحلول ؟ (علماً بأن الكتل الذرية: Na = 23, Cl = 35.5)
مثال (3): ما وزن كبريتات الأمونيوم (NH4)2SO4 الذي يلزم إذابتها في 350 g من الماء لتكوين محلول تركيزه (0.3 molal) ؟ (علماً بأن الكتل الذرية: H = 1, N = 14, O= 16, S = 32).
الجواب النهائي : m(NH4)2SO4 = 13.86g
مثال (4): أحسب تركيز كلوريد الصوديوم NaCl بوحدة المولالية ، إذا أذيب منه 43 g في 108 g من الماء (H2O). (علماً بأن الكتل الذرية: Na = 23, Cl = 35.5)
الحل:
يتم حل المسألة كما يلي:
مثال (5): ما تركيز محلول بالمولالية حضر بإذابة (0.1 mol) من مادة ما في لتر من الماء (علماً بأن كثافة الماء = 1g/cm3)
الحل:
يتم حل المسألة كما يلي:
مثال (6): حضر محلول بإذابة 15 g من كبريتات الصوديوم Na2SO4 في 125 g من الماء، احسب التركيز بالمولالية ؟ (علماً بأن الكتل الذرية: O = 16, Na = 23, S = 32)
يتم حل المسألة كما يلي:

مثال (7): كم جراماً من الجلوكوز C6H12O6 يلزم إذابته في 150 g من الماء لتحضير محلول تركيزه 0.2 molal ؟ (علماً بأن الكتل الذرية H = 1, O = 16, C = 12 :)
الحل:
يتم حل المسألة كما يلي:
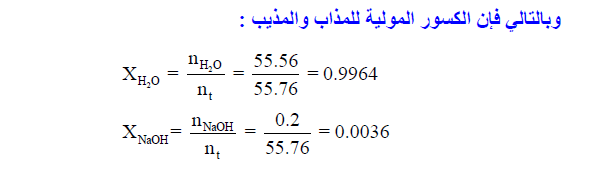
مثال (8): احسب الكسور المولية لمذاب ومذيب فى محلول مائي لهيدروكسيد الصوديوم NaOH تركيزه 0.2 molal ؟ (علماً بأن الكتل الذرية H = 1, O = 16, Na = 23 :)
الحل :
يتم حل المسألة كما يلي:

مثال (9): يحتوي محلول على 57.5 cm3 من الكحول الإيثيلي و 600 cm3 بنزين C6H6 ، فما مولالية المحلول علماً بأ كثافة الكحول 0.8 g/cm3 وللبنزين 0.9 g/cm3 ؟(علماً بأن الكتل الذرية H = 1, O = 16, C = 12 :)
الحل:
يتم حل المسألة كما يلي:
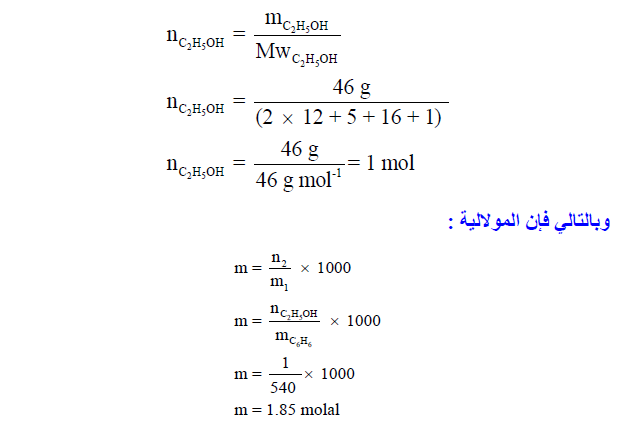
تمارين على المولالية Molality
مثال (10): أحسب المولالية لمحلول مكون من (938 g) من حمض الكبريتيك في 200ml من المحلول ذي الكثافة 1.2g/ml ؟ (علماً بأن الكتل الذرية H = 1, O = 16, S = 32 )
الجواب النهائي:
molalMolality = 0.43
مثال (11): أحسب الجزيئية الوزنية (المولالية) لمحلول هيدروكسيد الصوديوم NaOH عندما تكون النسبة المئوية لــ NaOH هي 14% علماً بأن الكتل الذرية H = 1, O = 16, Na = 23):)
الجواب النهائي : بفرض أن وزن المحلول msol = 100 g فإن : Molality = 4.07 molal
وللتعرف على قوانين النسبة المئوية الوزنية : أضغط هنا
مثال (12): محلول هيدروكسيد البوتاسيوم KOH المائي تركيزه (40%) وزناً . احسب ما يلي :
أ- التركيز بالمولالية
ب- الكسر المولي للمذاب
جـ – الكسر المولي للمذيب
(علماً بأن الكتل الذرية H = 1, O = 16, K = 39 :)
الجواب النهائي:
فى المسألة لم يذكر كتلة المذاب والمذيب لذلك فرضنا أن كتلة المحلول تساوي 100 g ، وبما أن النسبة المئوية الوزنية للمذاب هي 40% فبالتالي كتلته تساوي 40 g لأن كتلة المحلول 100 g
أ- المولالية = 11.9 molal
ب- XKOH = 0.177
جـ – XH2O = 0.823
كما يمكنك التعرف على قوانين النسبة المئوية الوزنية : أضغط هنا ، وللتعرف على قوانين الكسر المولي :أضغط هنا
تمارين أخري
مثال (13): لديك محلول مائي للسكروز C12H22O11 فإذا علمت أ الكسر المولي للسكروز 0.25 احسب:-
أ- التركيز بالمولالية
ب- النسبة المئوية الوزنية
(علماً بأن الكتل الذرية H = 1, O = 16, S = 32 :)
الجواب النهائي :
أ- المولالية = 18.52 molal
ب- Wt% = 86.36%
كما يمكنك التعرف قوانين النسبة المئوية الوزنية : أضغط هنا ، وللتعرف على قوانين الكسر المولي :أضغط هنا
مثال (14): محلول مائي للحمض الخل CH3COOH تركيزه 10.2 molal احسب:-
أ- الكسر المولي للمذاب والمذيب
ب- النسبة المئوية الوزنية للحمض
الجواب النهائي : بفرض أن وزن المذيب 1000 g فإن :
أ- XCH3COOH = 0.155 , XH2O = 0.845
ب- Wt% = 37.97%
وللتعرف على قوانين النسبة المئوية الوزنية : أضغط هنا ، وللتعرف على قوانين الكسر المولي :أضغط هنا
مثال (15): محلول مائي لنترات الصوديوم NaNO3، الكسر المولي لنترات الصوديوم فيه 0.45 أحسب التركيز بالمولالية ؟ (افرض أن عدد مولات المحلول = 1 mol )
الجواب النهائي : Molality = 45.45 molal
كما يمكنك التعرف على قوانين الكسر المولي : أضغط هنا
المراجع : المولالية Molality – الفصل الأول / طرق التعبير عن التركيز من كتاب أسس الكيمياءالعامة والفيزيائية للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء كلية العلوم -جامعة أم القري.



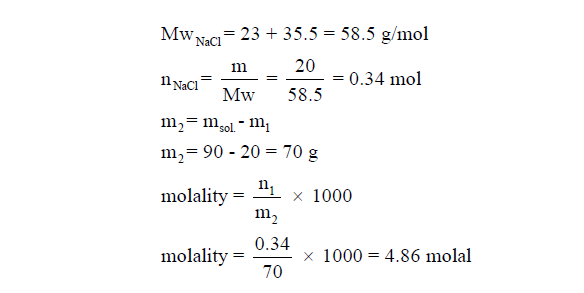
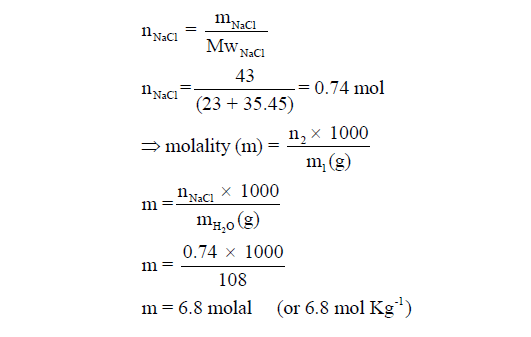









ممكن ترسل به ملف pdf
ممكن pdf
النسبة المئوية الحجمية للأسيتون في محلوله هي 34%(V/V) وإذا كان حجم المحلول 250ml أحسبي حجم الأسيتون في المحلول
اكتبي سؤالك على موقع اسألنى كيمياء وسوف نجيب عن سؤالك بالتفصيل حيث أن موقع/ اسألنى كيمياء أحد سلسلة مواقع تعرف على علم الكيمياء
ممكن حل س/أحسب النسبة الكتلية لكل من حامض الهيدروكلوريد والماء عند تخفيف (20g)منHclفي(80g)من الماء المقطر
ممكن الحل رجأن
اذيب (20g) من الماء في محلول (NaoH)واصبح حجم المحلول (250ml)احسب (ph)؟
لماذا يتم استخدام 4.5g من هيدروكسيد الصوديوم لتحضير 100مل من محلول 1N NaOH
محلول تركيزه المولالي صفر واتنين من عشره وتركيزه المئوي صفر وتمانيه من عشره في المائه تكون الكتله الموليه
ارجو الرد بسرعه
ضعي سؤالك على موقع/ اسألني كيمياء فهو موقع تابع لنا وسوف نجيب عليك بالتفصيل
كم عدد مولات المذاب في واحد مول من الصوظيوم سلفيت؟
احتاج جواب ل س /احسب التركيز بالمولارية لمحلول ناتج عن اذابة 4mol في كمية من الماء ليتكون محلول حجمة 8L