طرق حساب الوزن المكافئ Equivalent weight
في البداية سوف نتطرق إلي بعض التعريفات الهامة المتعلقة بموضوع الوزن المكافئ، وفى نهاية الموضوع سوف نعرض القوانين الخاصة بالأوزان المكافئة مع الأمثلة والتمارين المحلولة.

(1) الوزن المكافئ في تفاعلات التعادل
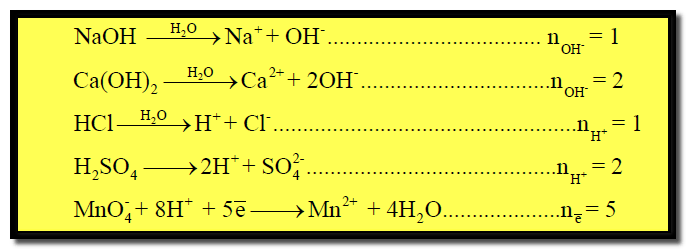
ويمكن تعريف الوزن المكافئ للمادة في تفاعلات التعادل بأنه وزن المادة التي تنتج أو تتفاعل أو تكافئ كيميائياً بروتوناً واحداً (H+) في ذلك التفاعل.
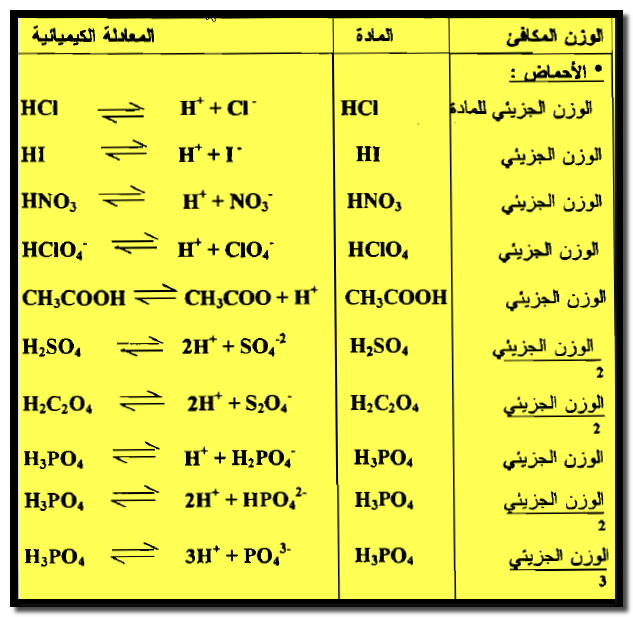
(2) الوزن المكافئ للحمض
هو وزن الحمض الذي ينتج جراماً ذرياً واحداً من أيون الهيدروجين ( بروتون واحد) كما في الأمثلة التالية:
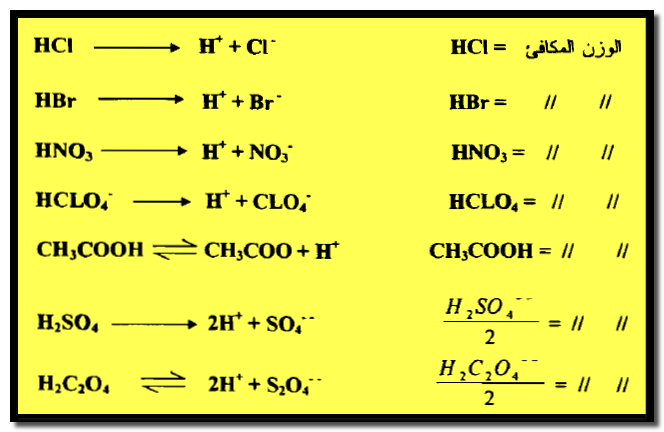
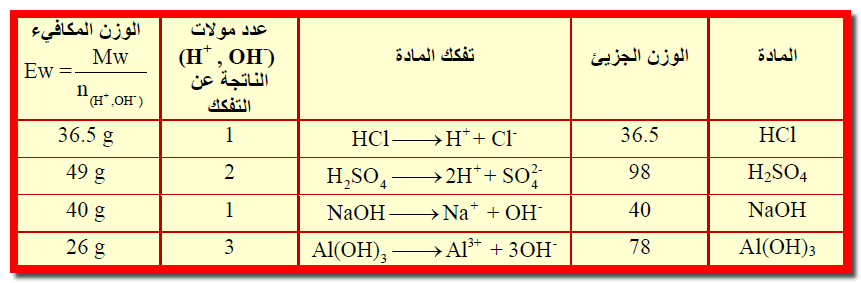
– إن الوزن المكافئ لحمض أحادى القاعدية مثل حمضCH3COOH ، HCl ، HBr ، HNO3 ، HClO4 يكون وزنه الجزيئي نفسه ، بحيث أن كل جزئية من هذه الأحماض ينتج بروتوناً واحداً (H+) في تفاعل التعادل
– يكون الوزن المكافئ لحمض ثنائي القاعدية مثل حمض الكبريتيك أو حمض الأكساليك نصف وزنه الجزيئي.
– كما أن الوزن المكافئ لحامض ثلاثي القاعدية يساوي ثلث وزنه الجزيئي.
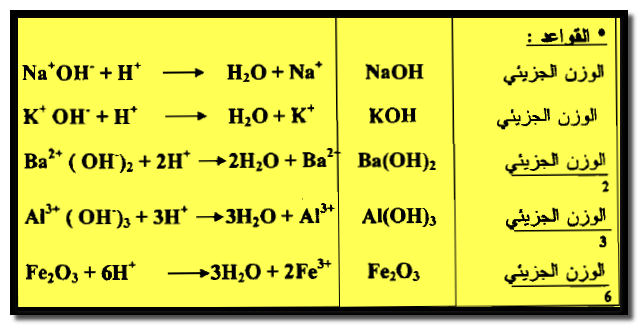
(3) الوزن المكافئ للقاعدة
– يعرف الوزن المكافئ للقاعدة بأنه الوزن الذي ينتج جرام – أيون من الهيدروكسيد (OH–) .
– وبالرغم من أن هذا التعريف واف للقواعد مثل: NaOH ، KOH ، Ca(OH)2 ، Ba(OH)2 ، Fe(OH)3 ، Al(OH)3 …….. الخ.
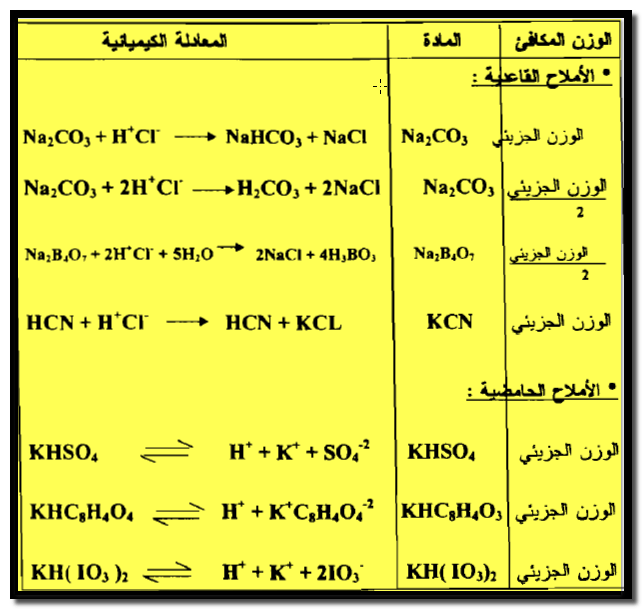
(4) الوزن المكافئ للأملاح القاعدية
(5) الوزن المكافئ للأملاح الحمضية
(6) الأوزان المكافئة للعوامل المؤكسدة والمختزلة
– يعرف الوزن المكافـئ للعامل المؤكسد أو المختزل بأنه الوزن الذي يكتسب أو يحرر الكتروناً واحداً أو الذي يعاني تغيراً بعدد التأكسد Oxidation number مقداره واحد .
– ويمكن حساب الوزن المكافـئ للعامل المؤكسد أو المختزل كما يلي:
- تقسيم الوزن الجزيئي للمادة على التغير الكلي في عدد التأكسد الحادث في عملية التأكسد والاختزال.
- أو بتقسيم الوزن الجزيئي للمادة على عدد الإلكترونات المكتسبة أو المفقودة أثناء تفاعل مول واحد من المادة.
تكون قيمة الوزن المكافـئ للعامل المؤكسد أو المختزل غير ثابته وتعتمد على نوعية التفاعل الحاصل.
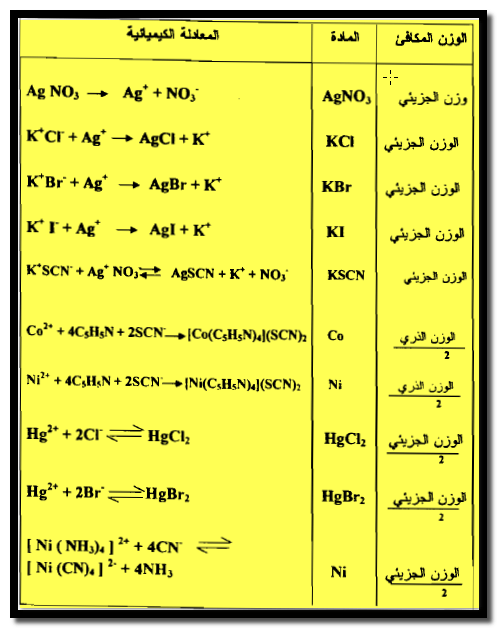
(7) الوزن المكافئ في تفاعلات الترسيب أو تكوين المعقدات
هو الوزن الذي يحرر أو يتفاعل أو يكافئ كيميائياً جراماً ذرياً واحداً من أيون موجب أحادي التكافؤ أو نصف جرام ذري من أيون موجب ثنائي التكافؤ أو ثلث جرام ذري من أيون موجب ثلاثي التكافؤ.
أما الوزن المكافـئ في تفاعلات الترسيب فهو الوزن الجزيئي الجرامي لذلك الملح مقسوماً على تكافؤ الأيون المتفاعل كما هو واضح في الجدول التالي:
القوانين والمسائل المحلولة على الوزن المكافـئ
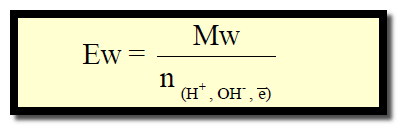
حيث n: تعبر عن عدد المولات من وحدات أيونات الهيدروجين (H+) أو الهيدروكسيد (OH–) أو عدد الإلكترونات المشاركة في تفاعلات الأكسدة والاختزال .
أمثلة توضيحية
(1) مول واحد من حمض الكبريتيك H2SO4 يحتوي على مولين (2 moles) من أيونات الهيدروجين (H+).
(2) مول واحد من قاعدة هيدروكسيد الصوديوم NaOH يحتوي مولاً واحداً من أيونات الهيدروكسيد (OH–)
(3) مول واحد من هيدروكسيد الكالسيوم Ca(OH)2 يحتوى على مولين من أيونات الهيدروكسيد.
والأمثلة التالية توضح ذلك:
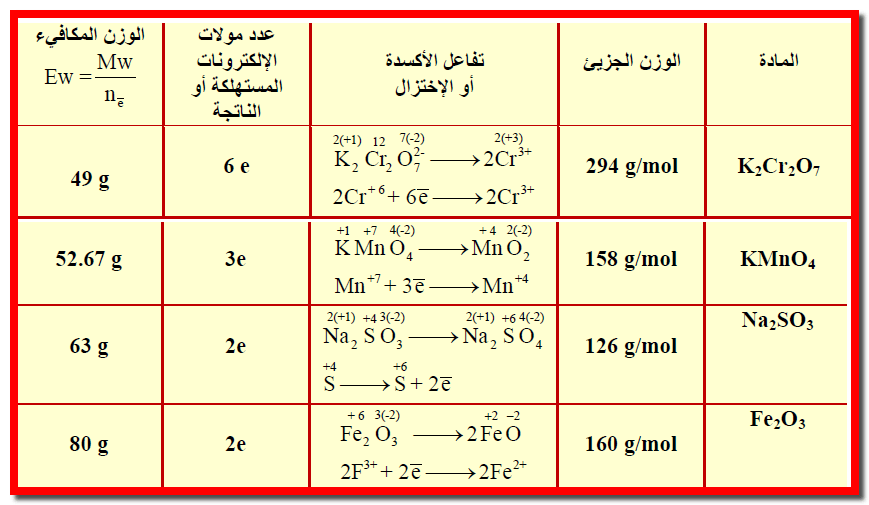
مثال (2): أحسب الوزن المكافـئ لكل مما يلي:
1- دايكرومات البوتاسيوم K2Cr2O7عند إختزالها إلى Cr+3
2- برمنجنات البوتاسيوم KMnO4 عند اختزاله إلى MnO2
3-Na2SO3 إلى Na2SO4
4- Fe2O3 إلى FeO
علماً بأن الأوزان الذرية كالتالي : ( O =16 , K =39 , Cr =52 , Mn =55 , Na =23 , S =32 , Fe =56 )
الحل:
المراجع:
- الوزن المكافـئ Equivalent weight – الباب الرابع / أساسيات التحليل الحجمي Principles of Volumetric analysis من كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي ) للمؤلف / محمد مجدي عبدالله واصل. أستاذ قسم الكيمياء كلية العلوم – جامعة الأزهر الشريف.
- الوزن المكافـئ – الفصل الأول / طرق التعبير عن التركيز من كتاب أسس الكيمياء العامة والفيزيائية للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء كلية العلوم – جامعة أم القري.