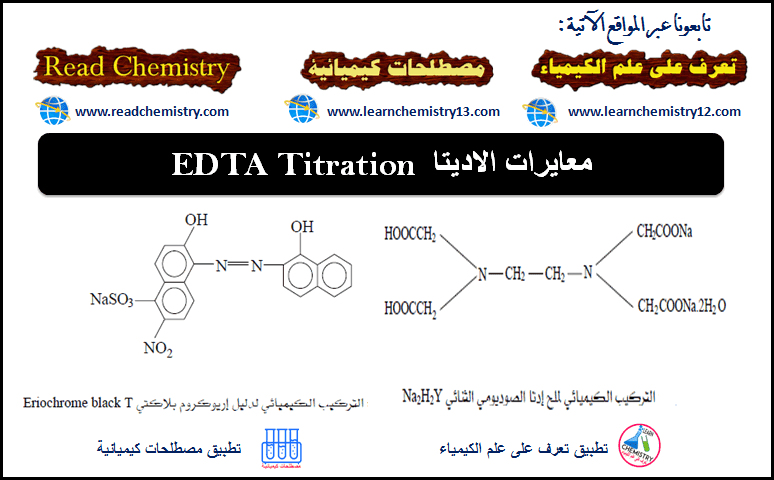
الكيمياء التحليلية
تعيين عيارية NaCl باستخدام محلول قیاسي من AgNO3 (طريقة موهر)
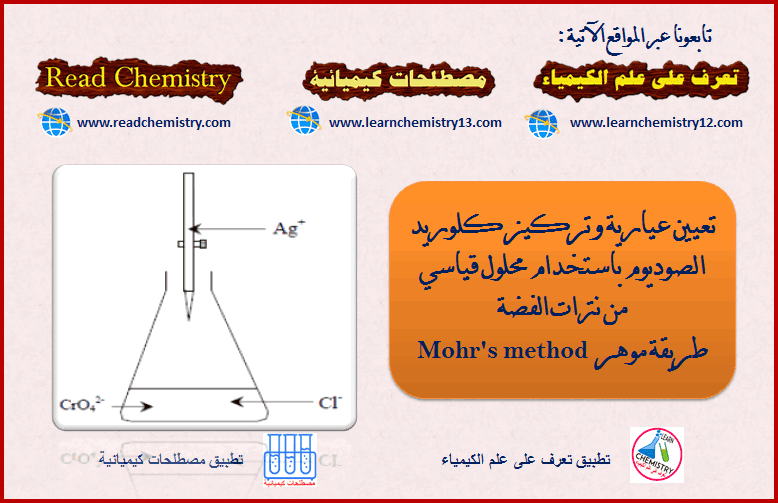
طريقة موهر Mohr’s method
– طريقة موهر هي أحدى الطرق المستخدمة لتحديد نقطة النهاية في معايرات الترسيب (طرق القياس الفضي).
– يستخدم في هذه الطريقة دليل أيون الكرومات CrO42- Chromate ion والذي يتفاعل مع الفضة (المضاف من السحاحة) عند نقطة التكافؤ ويكون راسباً أحمر مع أول قطرة زائدة من الفضة.
– يستخدم في هذه الطريقة دليل أيون الكرومات CrO42- Chromate ion والذي يتفاعل مع الفضة (المضاف من السحاحة) عند نقطة التكافؤ ويكون راسباً أحمر مع أول قطرة زائدة من الفضة.
– تصلح هذه الطريقة لمعايرة أيونات الكلوريد والبروميد بواسطة محلول قياسي من نترات الفضة.
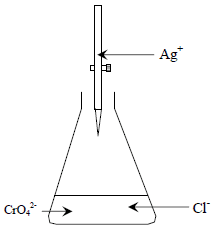
– الشكل التالي يوضح طريقة موهر:
قبل نقطة التكافؤ Before end-point
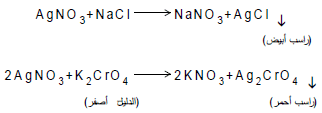
قبل نقطة التكافؤ فإن أي إضافة من نترات الفضة (في السحاحة) على محلول الكلوريد مثلاً (في الدورق) يؤدي إلى ترسيب كلوريد الفضة ذات اللون الأبيض. ويترسب كلوريد الفضة أولاً بسبب أن حاصل إذابته أقل من حاصل إذابة كرومات الفضة.

عند نقطة التكافؤ At end-point
عند نقطة التكافؤ أي بعد ترسيب كل أيونات الكلوريد من المحلول فإن أول قطرة زائدة من أيونات الفضة سوف ترسب أيونات الكرومات (الدليل) على هيئة كرومات الفضة (راسب أحمر) والتي تدل على نقطة النهاية علماً بأن المعادلة رقم (1) تمثل تفاعل المعايرة والمعادلة رقم (2) تمثل تفاعل الدليل.
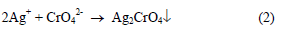
ملاحظات هامة عن طريقة موهر
يجب إنجاز هذه الطريقة في رقم هيدروجيني pH = 7-8 ولك للأسباب الآتية:
(أ) إذا كان المحلول حمضياً يحدث التفاعل الجانبي التالي حيث يتحول الدليل إلى مادة أخرى وهي البيكرومات مما يؤدي إلى نقصان في كمية الدليل.
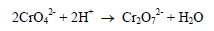
(ب) إذا كان المحلول قاعدياً نجد أن أيونات الفضة تترسب على هيئة هيدروكسيد الفضة وهذا بالطبع يؤثر على أداء المحلول المعاير ويعطي نتائج سلبية. ويمكن إضافة كربونات الكالسيوم للحفاظ على الرقم الهيدروجيني.
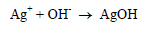
التجربة
– معایرة محلول عینة من كلورید الصودیوم باستخدام محلول قیاسي من نترات الفضة (0.1N)
– تستخدم في هذه التجربة طريقة موهر في تحديد نقطة نهایة التفاعل (نقطة التكافؤ) وباستخدام كرومات البوتاسيوم كدلیل.
.(Determination of Normality of NaCl by standard solution from AgNO3 (Mohr’s method
الهدف من التجربة
(1) تعتبر التجربة أحد تطبيقات معايرات الترسيب (طريقة موهر).
(2) تعیين عیاریة ومولاریة والتركیز بالوحدات المختلفة لمحلول عینة من كلورید الصودیوم.
معادلات التفاعل
الأدوات والمواد المطلوبة لإجراء التجربة
(1) السحاحة
(2) حامل السحاحة
(3) الدورق المخروطي (دورق المعایرة)
(4) ماصة حجمیة
(5) كأس
(6) ساق زجاجیة.
(7) محلول قیاسي من نترات الفضة AgNO3 (0.1N)
(8)عینة من محلول كلورید الصودیوم مجهولة التركیز.
(9) محلول كرومات البوتاسیوم (0.2N)
تحضير المواد الكيميائية المستخدمة في التجربة:
(1) یتم تحضیر محلول نترات الفضة بأخذ وزنه من ملح نترات الفضة مقدارها 8.5 جم من ملح نترات الفضة المجففة عند درجة حرارة 120 Co لمدة ساعة ونصف ثم یذاب هذا الوزن في دورق قیاسي سعة 500 مل ماء خالي من الأيونات ثم ترج جیدا ثم تحفظ في زجاجة بنیة اللون.
(2) بالنسبة لمحلول العینة المجهولة من كلورید الصودیوم فیتم تحضيرها بإذابة وزنها تتراوح من (0.25 – 0.1 جم) من ملح كلورید الصودیوم في حجم مقداره 100 مل ماء خالي من الأيونات في دورق مخروطي أو كأس.
(3) یتم تحضیر الدلیل بإذابة (1.941 جم) من ملح كرومات البوتاسيوم K2CrO4 في حجم مقداره (100مل خالي من الايونات).
خطوات التجربة
(1) نظف أدوات التجربة جیداً بالماء المقطر.
(2) بواسطة الماصة القیاسیة خد 50 مل من محلول عینة كلورید الصودیوم المجهول في الدورق المخروطي.
(3) أضف إلي الدورق المخروطي 1 مل من دلیل كرومات البوتاسیوم او حوالي 10 قطرات بزجاجة الكاشف.
(4) املأ السحاحة بعد تنظیفها بقلیل من محلول نترات الفضة القیاسي لإزالة قطرات الماء وتأكد من عدم وجود فقاعات هواء وامتلأ الجزء ما تحت الصنبور.
(5) ابدأ عملیة المعایرة بتنقیط المحلول القیاسي من السحاحة قطرة قطرة مع الرج المستمر واستمر في عملیة المعایرة حتى ظهور راسب احمر ثابت لا یختفي بالرج وسجل الحجم المستهلك من السحاحة ولیكن (V1) مل.
(6) كرر عملیة المعایرة ثلاثة مرات واحسب متوسط الحجم ولیكن (V)
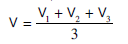

الحسابات
– یتم حساب عیاریة كلورید الصودیوم من العلاقة التالیة:
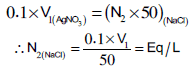
(V1) مل تمثل متوسط الجحم المحسوب سابقا
– یتم حساب المولاریة من العلاقة التالیة:
M = N/n
حيث (n) تكافؤ الايون المشترك في الترسيب والايون المشترك في الترسيب أحادي التكافؤ (ايون الكلوريد).
M = N
– حساب التركیز بالجرام/لتر:
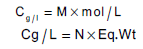
– حساب التركیز بالمیكرومول/ 10 مل:
ملاحظة:
الحجم المستخدم في المعایرة (حجم كلورید الصودیوم ) یترك تحدیده مدرب المعمل ولكن كلما كان الحجم كبیر تكون نقطة التكافؤ أوضح بحیث یكون اللون المتكون واضح جدا وهذا یقلل من خطا المعایرة.
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة الآتي:
(1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به .
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها ، ولا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض
(3) يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف .
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها .
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط .
(6) يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات ويجب الانتباه عند تغطية زجاجات الكيماويات .
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها ، واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلامة .
(8)عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي .
ويجب أيضاً:
(9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط ، بلل الزجاج بالماء أو الزيت أولاً لان ذلك يسهل ألي حد كبير هذه العملية .
(10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه .
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر ، ومراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء
(12) يجب أن يكون بكل مختبر أكثر من مخرج ويفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يوميا ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة .
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه .
(15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر .
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وان تكون مزودة بمروحة سحب مناسبة.
المراجع:
– كتاب اساسيات الكيمياء التحليلية (تخصص مختبرات كيميائية 165 كيم) / المؤسسة العامة للتدريب التقنى والمهنى / السعودية / طبعة 1429م.
– كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها.
(10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه .
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر ، ومراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء
(12) يجب أن يكون بكل مختبر أكثر من مخرج ويفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يوميا ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة .
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه .
(15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر .
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وان تكون مزودة بمروحة سحب مناسبة.
المراجع:
– كتاب اساسيات الكيمياء التحليلية (تخصص مختبرات كيميائية 165 كيم) / المؤسسة العامة للتدريب التقنى والمهنى / السعودية / طبعة 1429م.
– كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها.