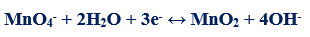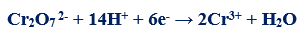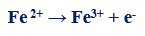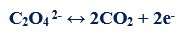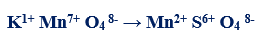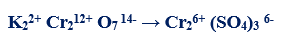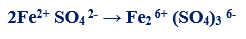حساب الوزن المكافئ للعوامل المؤكسدة والمختزلة
محتويات الموضوع
كيفية حساب الوزن المكافئ للعوامل المؤكسدة والمختزلة
– يمكن حساب الوزن المكافئ للعوامل المؤكسدة والمختزلة Equivalent Weight of Oxidizing and Reducing agents بطريقتين كما يلي:
- الطريقة الأولى/ عن طريق وزن معادلات الأكسدة والاختزال.
- الطريقة الثانية/ عن طريق التغير في عدد التأكسد.
– وسيتم مناقشة العديد من الأامثلة والتمارين لتوضيح حساب الوزن المكافئ للعوامل المؤكسدة والمختزلة.
حساب الوزن المكافئ عن طريق وزن معادلات الأكسدة والاختزال
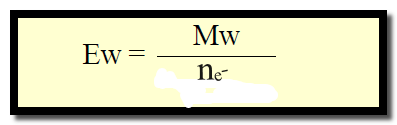
– وفي هذه الحالة يعرف الوزن المكافئ المادة المؤكسدة أو المختزلة هو المول (الوزن الجزيئي) مقسوماً على عدد الإلكترونات التي يكتسبها أو يفقدها مول واحد في التفاعل
– في هذه الطريقة لابد من وزن معادلات الأكسدة والاختزال ومعرفة عدد الإلكترونات المكتسبة أو المفقودة بواسطة مول واحد من المادة في التفاعل.
مسائل محلولة
مثال (1): في التفاعل التالي كما يلي:
– عدد الإلكترونات التي يكتسبها المنجنيز (مول واحد من البرمنجنات) = (+7) – (+2) = +5 إلكترونات
– الوزن المكافئ لبرمنجات البوتاسيوم KMnO4 = الوزن الجزيئي له ÷ 5
مثال (2): في التفاعل التالي كما يلي:
– عدد الإلكترونات التي يكتسبها المنجنيز (مول واحد من البرمنجنات) = (+7) – (+4) = +3 إلكترونات
– الوزن المكافئ لبرمنجات البوتاسيوم KMnO4 = الوزن الجزيئي له ÷ 3
مثال (3): في التفاعل التالي كما يلي:
– عدد الإلكترونات التي يكتسبها الكروم (مول واحد من الدايكرومات) = (+12) – (2 x +3) = +6 إلكترونات
– الوزن المكافئ للدايكرومات البوتاسيوم K2Cr2O7 = الوزن الجزيئي له ÷ 6
متال (4): في التفاعل التالي كما يلي:
– عدد الإلكترونات التي يفقدها الحديدوز (مول واحد من كبريتات الحديدوز) = (+2) – (+3) = -1 إلكترون
– الوزن المكافئ لكبريتات الحديدوز FeSO4 = الوزن الجزيئي ÷ 1
مثال (5): في التفاعل التالي كما يلي:
– عدد الإلكترونات التي يفقدها الكربون (مول واحد من حمض الأوكساليك) = (+6) – (2 x +4) = -2 إلكترون
– الوزن المكافئ لحمض الأوكساليك H2C2O4 = الوزن الجزيئي له ÷ 2
مثال (6): في التفاعل التالي كما يلي:
– عدد الإلكترونات التي يفقدها الكبريت (مول واحد من كبريتيت الصوديوم) = (+4) – (+6) = -2 إلكترون
– الوزن المكافئ لكبريتيت الصوديوم Na2SO3 = الوزن الجزيئي له ÷ 2
حساب الوزن المكافئ عن طريق التغير في عدد التأكسد
– وتعتمد هذه الطريقة لحساب الوزن المكافئ لمادة مؤكسدة أو مادة مختزلة على معرفة التغير في عدد التأكسد أو التكافؤ.
– الوزن المكافئ لمادة مؤكسدة او مختزلة = الوزن الجزئيي ÷ عدد التغير في عدد التأكسد
– عدد التأكسد هو عدد يدل على مقدار التأكسد أو الاختزال المطلوب لتحويل ذرة واحدة من ذلك العنصر من الحالة الحرة Free state إلى الحالة التي توجد في ذلك المركب.
– لحساب أعداد التأكسد يرجى مراجعة هذا الدرس: أعداد الأكسدة Oxidation Number
– يعين مكافئ مادة مؤكسدة بالتغير الذي يحدث في عدد التأكسد الذي يعانيه العنصر المختزل وهي كمية المؤكسد التي تدخل في تغير واحد في عدد التأكسد
مسائل محلولة
مثال (1): اختزال برمنجنات البوتاسيوم بوجود حمض الكبريتيك المخفف إلى ملح المنجنيز الثنائي كما بالمعادلة الآتية:
– التغير في عدد التأكسد للمنجنيز هو من 7+ إلى 2+ = +5 (أختزال)
– الوزن المكافئ برمنجنات البوتاسيوم = الوزن الجزيئي ÷ 5
مثال (2): اختزال دايكرومات البوتاسيوم في محلول حمضي كما بالمعادلة الآتية:
– التغير في عدد التأكسد للكروم هو من 12+ إلى 6+ = +6 ( أختزال)
– الوزن المكافئ لدايكرومات البوتاسيوم = الوزن الجزيئي ÷ 6
مثال (3): تأكسد كبريتات الحديدوز إلى كبريتات الحديديك كما بالمعادلة الآتية:
– التغير في عدد التأكسد بمول واحد للحديد هو من 2+ إلى 3+ = -1 ( أكسدة)
– الوزن المكافئ لكبريتات الحديدوز = الوزن الجزيئي ÷ 1
مثال (4): تأكسد حمض الأوكساليك إلى ثاني أكسيد الكربون والماء كما بالمعادلة الآتية:
– التغير في عدد التأكسد لذرتين من الكربون هو من 6+ إلى 8+ = -2 ( أكسدة)
– الوزن المكافئ لحمض الأوكساليك = الوزن الجزيئي ÷ 2
ملاحظات هامة على حساب الوزن المكافئ
(1) أن مكافئ عنصر يشترك في تفاعل تأكسدي – اختزالي هو كتلته الذرية مقسوماً على التغير في عدد التأكسدي.
(2) عندما تعاني ذرة في جزئ معقد تغيراً في عدد التأكسد (عملية تأكسد أو اختزال) فإن:
– مكافئ المادة هو المول مقسم على التغير في عدد التأكسد للعنصر المؤكسد أو المختزل.
– فإذا وجد أكثر من ذرة للعنصر المتفاعل فإن المول يقسم على التغير الكلي في عدد التأكسد.
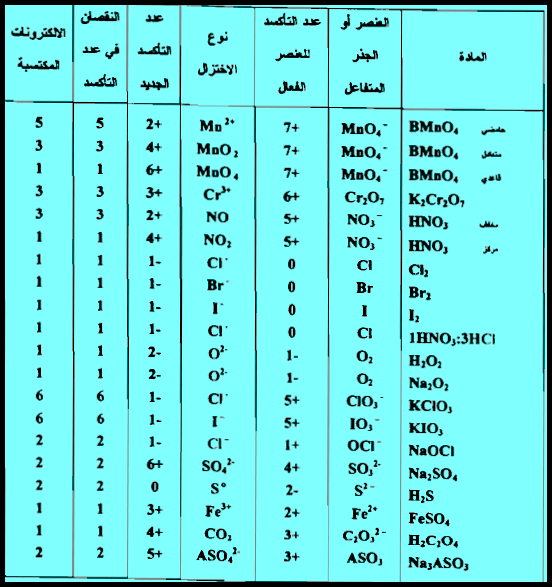
(3) الجدول التالي يوضح العوامل المؤكسدة والمختزلة الشائعة والمستعملة في الأغراض التحليلية كما يلي:
مسائل محلولة حساب الوزن المكافئ للعوامل المؤكسدة والمختزلة
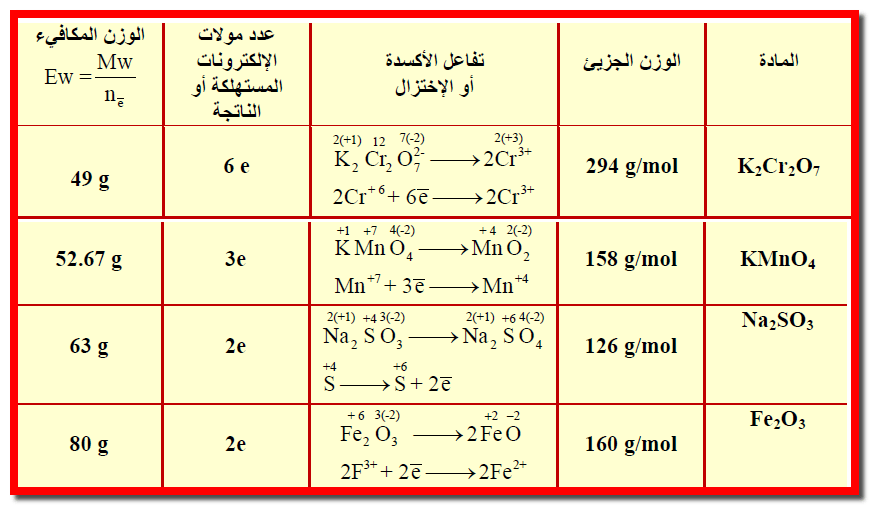
أحسب الوزن المكافئ لكل مما يلي:
(1) دايكرومات البوتاسيوم K2Cr2O7 عند إختزالها إلى Cr+3
(2) برمنجنات البوتاسيوم KMnO4 عند اختزاله إلى MnO2
(3) Na2SO3 إلى Na2SO4
(4)Fe2O3 إلى FeO
علماً بأن الأوزان الذرية كالتالي :
( O =16 , K =39 , Cr =52 , Mn =55 , Na =23 , S =32 , Fe =56 )
الحل:
– ستكون طريقة الإجابة كما يلي:
المراجع: كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي) / محمد مجدي عبد الله واصل جامعة الأزهر الشريف / دار الفجر للنشر والتوزيع / القاهرة