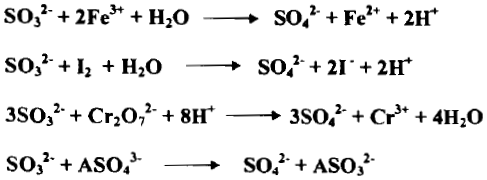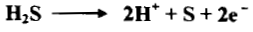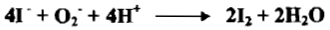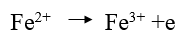العوامل المختزلة الأكثر شيوعاً في معايرات الأكسدة والاختزال
محتويات الموضوع
العوامل المختزلة في معايرات الأكسدة والاختزال
– فى هذا الموضوع سيتم مناقشة أهم العوامل المختزلة الأكثر شيوعاً في معايرات الأكسدة والاختزال Common reducing agents used in Redox reactions وهى كما يلي:
(1) ثاني أكسيد الكبريت SO2 أو حمض الكبريتوز H2SO3
(2) كبريتيد الهيدروجين H2S
(3) حمض الهيدرويوديك HI (أيون الأيوديد I–)
(4) كلوريد القصديروز SnCl2
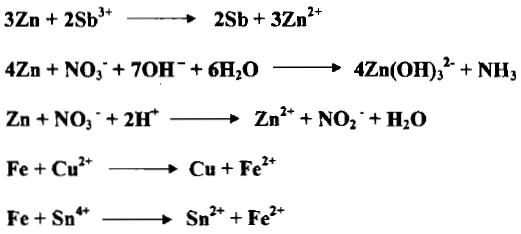
(5) الفلزات كالحديد والألومنيوم والزنك والفضة
(6) ثيوكبريتات الصوديوم Na2S2O3.5H2O
(7) مملغمات الفلزات.
(8) أيونات التيتانيوم الثلاثي (Ti+3) والكروم الثنائي Cr+2 والقصدير Sn+2
– یعد مجال استخدام تطبیق معایرات الاختزال أقل اتساعاً من معایرات المؤكسدة.
– والسبب في ذلك هو استقرار معایرات الاختزال حیث أن جمیع العوامل المختزلة المفیدة تمیل إلى تأكسد هوائي (أي بواسطة أكسجین الهواء الجوي).
– كلما كان العامل المختزل جیداً زاد میله للتفاعل مع الأكسجین.
– یمكن التغلب على هذه المشكلة بمعایرة المعایر بإستمرار لضبط تركیزه أما في الحالات الشدیدة فیمكن حمایة المعایر من الأكسجین بخزنة تحت هواء جوي مشبع بالنیتروجین.
– الجدول التالي یبین قائمة بالمعایرات المختزلة الشائعة كما يلي:
وفيما يلي سوف نسرد أهم العوامل المختزلة الهامة كما يلي:
(1) ثاني أكسيد الكبريت SO2 أو حمض الكبريتوز H2SO3
– عندما يذاب SO2 في الماء يكون حمض الكبريتوز الذي هو مختزل قوي.
– ويقوم على أساس تحول أيون الكبريت Sulphite SO3-2 إلى أيون الكبريتات Sulphate إذ يتحول العدد التأكسدي للكبريت من +4 إلى +6 وعليه ينطلق الكترونات في العملية كما يلي:
– يستعمل الكاشف أحياناً بزيادته على شكل كبريتيت الصوديوم Na2SO3 إلى المحلول المخصص المراد اختزاله وإليك عدداً من التفاعلات مع SO3-2 كما يلي:
(2) كبريتيد الهيدروجين H2S
– يستعمل غاز كبريتيد الهيدروجين محلوله المائي المشبع بوصفه مرسباً في التحليل الوصفي غير العضوي فإذا وجدت أيونات مؤكسدة في المحلول مثل Cr2O7-2 أو–MnO4 أو ASO4-3 أو مواد مثل HNO3 أو Cl2 فأنها تعاني تأكسداً فيتكون عنصر الكبريت S
– وإن رواسب الكبريتيدات المتكونة ستحتوي لذلك على الكبريت الحر. وإن المعادلات الآتية توضح هذه الحالة كما يلي:
(3) حمض الهيدرويوديك HI (ايون الأيوديد I–)
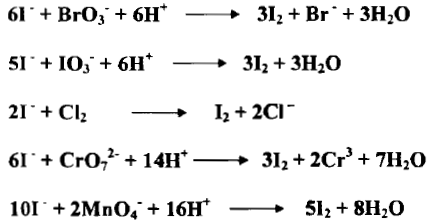
– إن أيون الأيوديد يختزل عدداً من المواد ويتأكسد بدوره إلى اليود حيث يستخدم لمعايرة الاجسام المؤكسدة في المعايرات اليودية غير المباشرة كما يلي:
– إذ يتغير العدد التأكسدي لليود من -1 إلى صفر.
– يوجد ايون الأيوديد غالباً على شكل KI ويجري الاختزال بـ I– كما يأتي:
– إذا ما حمض محلول KI بحمض الهيدروكلوريك المركز وترك المحلول معرضاً للهواء فإنه يتحول إلى اللون الأصفر ببطء كما يلي:
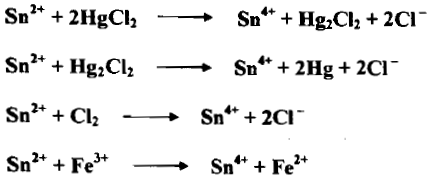
(4) كلوريد القصديروز SnCl2
– إن أيون القصدير الثنائي Sn+2 مختزل قوي ، إذ يتأكسد إلى القصدير الرباعي Sn+4 وذلك بفقدان إلكترونين كما يلي:
– أن الأمثلة التالية توضح الاختزالات بالقصدير الثنائي كما يلي:
– يتأثر محلول SnCl2 بالأكسجين الجوي فيتأكسد متحولاً إلى القصديريك كما يلي:
ولذلك لا يمكن حفظه معرضاً للهواء.
(5) الفلزات كالحديد والألومنيوم والزنك والفضة
– الحديد الثنائي (Fe(II يوجد بشكل ملح كبريتات الحديدوز النشادرية (ملح مور) وهو ملح مضاعف FeSO4(NH4)2SO4.6H2O سهلة الاكسدة بالهواء ولهذا نستخدم حمض الكبريتيك لمنع اكسدتها بالهواء.
– تستخدم أيونات الحديدوز لمعايرة حمض النتريك وأملاح النترات وثاني أكسيد المنجنيز … الخ.
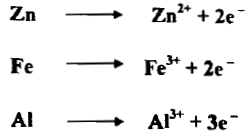
– تستعمل هذه الفلزات غالباً بوصفها عوامل مختزلة وإن فعلها يعود إلى تكوين أيوناتها وإطلاق الكترونات أي أنها تتحول من أوطأ حالة تأكسد لأيوناتها كما يلي:
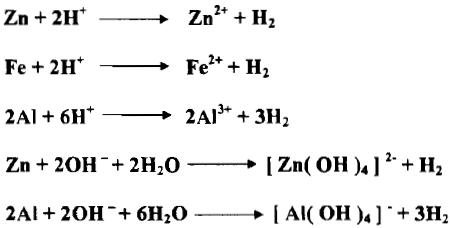
– ويمكن استعمال الزنك مثلاً عاملاً مختزلاً في كل من المحيط الحمضي والمحيط القاعدي كما يلي:
– إن التفاعلات التي يحدث فيها ذوبان الفلزات في الحوامض أو القلويات هي أيضاً عملية اختزال للكواشف المذيبة كما في التفاعلات الآتية:
(6) ثيوكبريتات الصوديوم Na2S2O3.5H2O
– محاليلها غير ثابتة وتتأثر بثاني اكسيد الكربون وبالأكسجين لهذا نحضر محاليلها باستخدام الماء الخالي من ثاني اكسيد الكربون وتحفظ في أوعية محكمة الغلق بعيداً عن الضوء.
– تؤثر البكتريا علي محاليلها لذلك تستخدم عدة قطرات من الكلوروفورم عند تحضير محاليلها , وهي تستخدم بشكل واسع في المعايرات اليودية غير المباشرة كما مرت معنا.
(7) مملغمات الفلزات
– تتمیز المختزلات الفلزیة بسهولة وذلك لإمكانیة إزالتها من النظام كما تستخدم في تحضیر المعایرات، بالإضافة إلى تنظیم حالة تأكسد النموذج.
– یمكن أستخدام المختزلات الفلزیة أما على صورة فلزات حرة كما ذكرنا اعلاه أو على صورة مملغمات مثل مملغم الخارصین (Hg-Zn) ومملغم الفضة (Hg-Ag).
– ومع أن استخدام كلا الصورتین متشابهة في التطبیقات العملیة إلا أن المملغمات تؤدي إلى اختزال تام. وتكون كمیة الفلز المستخدمة اقل (أي إن عملیة الاختزال أسرع).
– ویمكن أیضاً إعادة استخدام المملغم مرات عدیدة كذلك لیس من الضروري إجراء معایرات ضبط لها.
– تتلخص طریقة أستخدام هذه المختزلات الفلزیة كما يلي:
- ملء أنبوب زجاجي بقطع صغیرة من مملغم الخارصین.
- ثم تمرر العینة (تكون عادة محمضة بحمض الهیدروكلوریك أو الكبریتیك) خلال العمود بسرعة لا تتجاوز ( 25 مل/ دقیقة).
- یستخدم محلول حمضي لغسل المملغم ، وتخلیص ما تبقى من العینة فیه.
- ویجمع سائل العینة وسائل الغسیل معاً.
- ثم تجرى عملیة المعایرة.
– ومن أهم هذه المختزلات الفلزیة كما يلي بالجدول التالي:
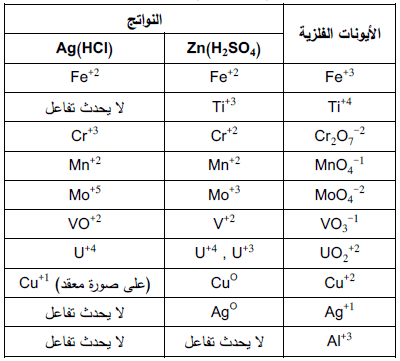
مملغم الخارصین كعامل مختزل
– یعد مملغم الخارصین عامل مختزل فعال یمكن استخدامه في تحضیر محالیل لأیونات التیتانیوم الثلاثي (Ti+3) و الكروم الثنائي (Cr+2) التي تعمل بدورها كعوامل مختزلة مفیدة.
– یعمل مملغم الخرصين المختزل على إزاحة أیونات كل من Ag , Cu محلول العینة وذلك باختزالها إلى الصورة من الفلزیة.
– من شروط استخدام هذا المختزل خلو محلول العینة من حمض النیتریك لأن الحمض یختزل إلى (NH2OH) والذي بدوره یتفاعل مع المعایر المؤكسد.
– كذلك یجب أن لا تحتوي العینة على بعض المواد العضویة مثل الخلات.
– ویمكن إزاحة هذه المواد إن وجدت في العینة بتسخین العینة مع حمض الكبریتیك المركز حتى تتصاعد أبخرة الحامض وذلك قبل أن تمرر العینة خلال العامل المختزل.
مملغم الفضة كعامل مختزل
– إن مملغم الفضة كعامل مختزل هو أقل قدرة على الاختزال من مملغم الخارصین.
– والسبب في ذلك یرجع الي ان الفضة تكون مغطاة بطبقة من كلورید الفضة.
– ولهذا السبب یفضل دأئما استخدام حمض الهیدروكلوریك علي حمض الكبریتیك كوسط حمضي عند أستخدام مملغم الفضة.
(8) أيونات التيتانيوم الثلاثي Ti+3 والكروم الثنائي Cr+2 والقصدير Sn+2
– تعد كل من أیونات التیتانیوم الثلاثي والكروم الثنائي والقصدیر الثنائي عوامل مختزلة قویة ، وبالتالي یمكن استخدامها كمواد معایرة.
– ومع ذلك فمن الصعوبة بمكان أستخدام هذه المواد في التطبیقات العملیة وذلك للأسباب الآتية كما يلي:
(1) میلها الشدید في التفاعل مع أكسجین الهواء الجوي.
(2) یجب تحضیرها قبل استعمالها مباشرة.
(3) یتم حفظها تحت غطاء من النیتروجین.
(4) یجب معایرتها وضبط تركیزها من وقت إلى آخر
المراجع:
- كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي) / محمد مجدي عبد الله واصل جامعة الأزهر الشريف / دار الفجر للنشر والتوزيع / القاهرة
- كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها