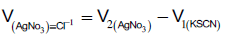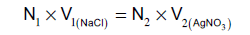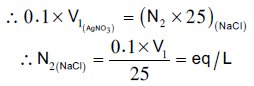في هذا الموضوع سيتم تعیین عیاریة وقوة كلورید الصودیوم بواسطة محلول قياسي من نترات الفضة باستخدام طريقة فولهارد Volhard’s method
الأساس النظري لطريقة فولهارد
– طريقة فولهارد هى أحدى طرق تحديد نقطة النهاية فى المعايرات الترسيبية
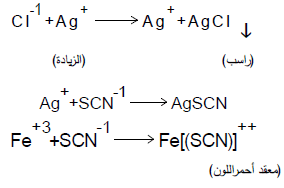
– یتم أستخدام طريقة فولهارد لتقدیر أیون الكلورید في الوسط الحمضي ولیس الوسط المتعادلة. وهذه الطریقة من المعایرة یطلق علیه أسم المعایرات الخلفیة (معایرة غیر مباشرة).
– تتم طريقة فولهارد بإضافة فائض معلوم من المحلول القیاسي (نترات الفضة) إلي محلول كلورید الصودیوم. وهذا الفائض یقدر حسب حجم العینة من محلول كلورید الصودیوم المأخوذ في الدورق المخروطي ، ثم تقدر الزیادة من نترات الفضة (أي نترات الفضة المتبقیة في المحلول) بمعایرتها بواسطة محلول قیاسي من ثیوسیانات البوتاسيوم (KSCN) وثيوسيانات الأمونيوم (NH4SCN).
– یستخدم شب الحدیدیك كدلیل في هذه المعایرة.
الهدف من التجربة
حساب عیاریة ومولاریة والتركیز بالوحدات المختلفة لمحلول عینة ما تحتوى كلورید الصودیوم عملیاً.
Determination of Normality and Strength of NaCl by standard solution of AgNO3 by using Volhard’s Methods
معادلات التفاعل
الأدوات والمواد المطلوبة
(1) السحاحة – حامل السحاحة – ماصة قیاسیة – دورق المعایرة – كأس سعة 400 مل – ساق زجاجیة.
(2) محلول قياسي من نترات الفضة (0.1 N (AgNO3
(3) محلول قياسي من ثایوسیانات البوتاسیوم (0.1 N (KSCN في حجم 500 مل ماء خالي من الأيونات.
(4) محلول من كبریتات الحدیدیدك والامونیوم (شب الحدیدیك) Fe2(SO4)3.(NH4)2SO4.24H2O . وتحضر بإذابة 10 جم من ملح كبریتات الحدیدیك والامونیوم في 100 مل ماء خالي من الأيونات ویضاف إلیها من( 5 – 10 مل) محلول حمض النیتریك المخفف (6 N) حیث یعمل الحمض على منع تمیؤ أیونات الحديد.
(5) محلول عینة مجهولة من كلورید الصودیوم. وتحضر بإذابة وزنه مقدراها 0.25 جم من الملح في 100 مل ماء خالي من الأيونات أو أي محلول من عینة تحتوى أیون الكلورید.
(6) محلول حمض النیتریك المخفف (6 N)
خطوات العمل
(1) نظف أدوات التجربة جیداً بالماء المقطر. ثم نظف السحاحة بقلیل من محلول الثایوسیانات القیاسي للتخلص من بقایا قطرات الماء المقطر.
(2) املأ السحاحة بمحلول ثایوسیانات البوتاسیوم القیاسي مع التأكد من امتلأ الجزء ما تحت الصنبور وعدم وجود فقاعات هواء في السحاحة.
(3) انقل بالماصة 25 مل من محلول كلورید الصودیوم المجهول التركیز إلي الدورق المخروطي.
(4) أضف إلي الدورق المخروطي 5 مل من محلول حمص النیتریك المخفف (6 N) لتحمیض الوسط ثم أضف الى محتویات الدورق حوالي 1جم من نترات البوتاسیوم أو 2 مل من النیتروبنزین وهذه الإضافات الأخیرة تعمل على تجمیع الراسب وعزله حتى لا یؤثر على نقطة التكافؤ.
(5) أضف إلي دورق المعایرة حجم فائض من نترات الفضة القیاسي. ویقدرهذا الفائض بحوالي 40 مل من محلول نترات الفضة. ویتم إضافة هذا الفائض على دفعات حوالي 5 مل في كل مرة مع الرج جیداً بعد كل إضافة لمدة 10 – 15 ثانیة حتى یتكون راسب كلورید الفضة. ثم رج الدورق المخروطي بشدة لدقائق ثم اترك المحلول یستقر ثم أضف قطرات من نترات الفضة. إذا حدت تعكیر في المحلول فهذا دلیل علي عدم الوصول الي نقطة التكافؤ، فیتم أضف كمیة أخرى من نترات الفضة حتى یتم التأكد من تكافؤ كل الكلورید الموجود في العینة.
(6) أضف الآن إلى الدورق حوالي 2 مل من محلول شب الحدیدیك (الدلیل).
(7) عایر المحلول بتنقیط محلول الثایوسیانات القیاسي من السحاحة قطرة قطرة حتى الوصول إلي نقطة نهایة التفاعل (نقطة التكافؤ)، أي حتى یتلون المحلول باللون البني الأحمر، وسجل حجم الثایوسیانات المستهلك من السحاحة ولیكن (V) مل
(8) كررالخطوات من ( 7، 4) وخد متوسط ثلاثة حجوم من السحاحة ولیكن متوسط الحجم (v1) مل
الحسابات
– حجم نترات الفضة الذي یكافئ كلورید الصودیوم =
حجم الفائض من نترات الفضة – حجم الثایوسیانات المستهلك من السحاحة
– نحسب عیاریة كلورید الصودیوم المجهولة بتطبیق المعادلة الاتیة:
بعد حساب العیاریة یمكن حساب التركیزات الأخرى وذلك بتطبیق القوانین الخاصة بكل حساب من الحسابات المطلوبة.
ملاحظة هامة
أن الحجم الفائض من نترات الفضة یتم تقدیره حسب الخبرة المعملیة وذلك عن طریق إضافات حجمیة ثابتة من محلول النترات القیاسي على دفعات (حوالي 5 مل) مع الرج عقب كل إضافة حتى الوصول إلي ترسیب كل الكلورید الموجود في محلول العینة. ویتم التأكد من ذلك بإضافة قطرات من نترات الفضة على محتویات الدورق بعد أن یستقر الراسب. فإذا لم یحدث تعكیر یكون هذا هو الجحم اللازم إضافته. وإذا حدث تعكیر یمكن إضافة دفعات أخرى بنفس الطریقة الأولى حتى یكتمل الترسیب وذلك لتقدیر أیون الكلورید بصورة دقیقة وتامة.
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة الآتي:
(1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به .
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها ، ولا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض
(3) يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف .
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها .
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط .
(6) يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات ويجب الانتباه عند تغطية زجاجات الكيماويات .
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها ، واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلامة .
(8)عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي .
(9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط ، بلل الزجاج بالماء أو الزيت أولاً لان ذلك يسهل إلي حد كبير هذه العملية .
(10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه .
ويجب أيضاً:
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر ، ومراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء.
(12) يجب أن يكون بكل مختبر أكثر من مخرج ويفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج.
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يوميا ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة .
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه .
(15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر .
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وان تكون مزودة بمروحة سحب مناسبة.
المراجع: كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها.