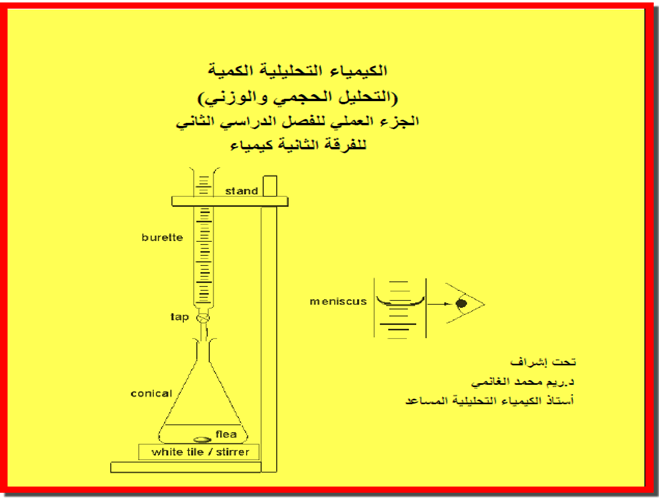
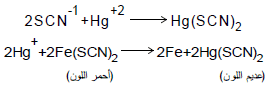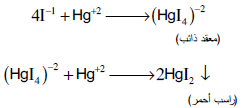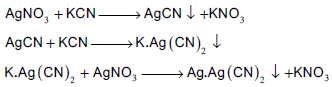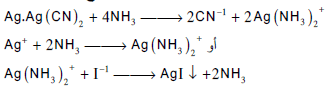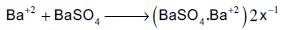الطرق المستخدمة في معايرات الترسیب Precipitation Titrations

معايرات الترسيب Precipitation titrations
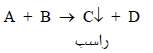
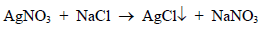
– یجب تحدید نقطة نهایة التفاعل بسهولة ودقة ویجب أن تكون واضحة لأن نقطة التكافؤ هي العامل الحاسم والأساسي في معایرات الترسیب.
الطرق المستخدمة في معایرات الترسیب Precipitation titrations
– تتم معایرة المادة المراد تحلیلها في هذه الطرق بواسطة محلول قياسي ككاشف ومرسب.
أولاً/ القياسي الفضي لمعايرات الترسیب
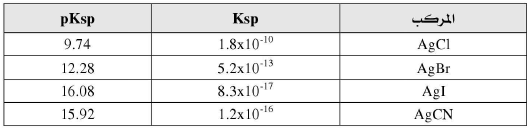
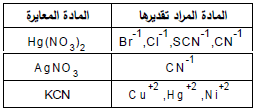
– تستخدم هذه الطرق لمعایرة الهالیدات (كلور، بروم، یود) ، واشباه الهالیدات (السیانید ، والكبریتید، والثایوسیانات). ویمكن أیضا تعیین الفضة في محالیلها باستعمال محلول قیاسي من كلورید الصودیوم أو البوتاسیوم.
– وتنقسم معایرات الفضة الى قسمین:
(1) معایرات مباشرة.
(2) معایرات غیر مباشرة.
– المعايرات المباشرة: یتم في هذا النوع معایرة محلول الهالید مباشراً مع محلول نترات الفضة القياسي حتى الوصول إلي نقطة النهایة.
– المعايرات الغير مباشرة : یتم بإضافة زیادة من محلول نترات الفضة القیاسي. ثم یتم معایرة الزیادة من نترات الفضة القیاسي بواسطة محلول قیاسي من (ثایوسیانات البوتاسیوم أو ثایوسیانات ألامونیوم).
ثانياً/ القياسي الزئبقي لمعايرات الترسیب
– هذه الطریقة تمثل المعایرات titrations التي یستعمل فیها محلول نترات أو بیركلورات الزئبقیك. وذلك لأن هذه الأملاح تامة التأین عكس أملاح الزئبقیك الأخرى.
– ویمكن استخدام محلول الزئبقیك القیاسي في تقدیر الكلوریدات والبرومیدات والثایوسیانات التي تكون رواسب من كلوریدات وبرومیدات وثایوسیانات الزئبقیك وهي أملاح ضعیفة التأین.
– عند استعمال هذه الطریقة لتقدیر كمیات قلیلة من الكلوریدات في وسط حامضي یستخدم محلول نیتروبروسیدالصودیوم (Na2Fe(CN)5NO) كدلیل لأنه یكون مع أیون الزئبقیك ملحاً قلیل الذوبان في الماء وهذا بدوره یسبب عكارة للمحلول عند نقطة نهایة التفاعل.
– في حالة الثایوسیانات فیستعمل شب الحدیدیك كدلیل ونقطة نهایة التفاعل هي النقطة التي یختفي فیها لون ثایوسیانات الحدیدیك الأحمر من المحلول كما في المعادلات الاتیة:
– تستعمل أيضاً طریقة القیاسي الزئبقي لتقدیر الیودات بمعایرتها مع محلول الزئبقیك القیاسي فیتكون أولاً مركب معقد ذائب وعند نقطة نهایة التفاعل یظهر راسب احمر هو یودید الزئبقیك الأحمر.
ثالثاً/ القياسي السيانيدي لمعايرات الترسیب
– بهذه الطریقة یمكن تعیین محالیل السیانید باستخدام محلول قیاسي من نترات الفضة. ویطلق على هذه الطریقة طریقة ( لیبج) أو طریقة التعكیر.
– تعتمد هذه الطریقة على ظهورعكارة في المحلول عند نقطة النهایة. حیث يعایر محلول السیانید بمحلول قیاسي من نترات الفضة وفي بدایة التسحیح یتكون راسب ابیض من سیانید الفضة سرعان ما یذوب بالرج في زیادة من السیانید لیكون مركب فضو سیانید البوتاسیوم ، وعند نقطة النهایة حیث ینفذ أیون السيانید فان إضافة قطرة من نترات الفضة یسبب ظهور عكارة في المحلول عند نقطة النهایة بسبب تكون راسب فضو سیانید الفضة كما هو موضح في المعادلات الآتية:
– ومن عیوب هذه الطریقة صعوبة تعیین نقطة التعكیر بالضبط. ویمكن التغلب على هذه الصعوبة بإضافة قلیل من محلول االامونیا ویودید البوتاسیوم كدلیل. حیث یمنع محلول الامونیا ترسب فضو سیانید الفضة ویترسب بدلاً منه یودید الفضة الأصفر للدلالة على نقطة النهایة كما توضح المعادلات الاتیة:
رابعاً/ معایرات الكبریتات مع كلورید الباریوم
یمكن تقدير الكبریتات بتسحیحها مع ایون الباریوم وذلك باستخدام دلیل الامتزاز (الألیزارین الأحمر أو الثورین) عند pH=3.5 (وسط حمضي قوي) في خلیط من الماء والكحول ، حیث تعطى كبریات الباریوم راسباً شدید الامتزاز یبقى معلقاً في المحلول.
ویمكن تمثیل المعایرة قبل نقطة النهایة بالمعادلة التالیة:
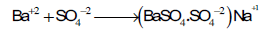
وبعد نقطة النهاية
الدليل يحل محل (X-1)في المعادلة السابقة لان الدلیل یعمل عمل أیون سالب ،بذلك یمكن رؤیة نقطة النهایة بسهولة. وذلك بمجرد تبدل لون المحلول من الأصفر إلي الوردي ویحدث التغیر على سطح الراسب.
المراجع:
– كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها
– المفاهيم الأساسية في التحليل التقليدي والآلي/ عبدالله محمود أو الكباش أستاذ الكيمياء التحليلية -جامعة الملك فهد للبترول والمعادن / الطبعة الأولي / 2012