تعیین عیاریة AgNO3 باستخدام محلول قياسي NaCl بطريقة موهر و فاجان
في هذا الموضوع سيتم تعیین عیاریة وقوة نترات الفضة باستخدام محلول قياسي من كلوريد الصوديوم وذلك بطريقتين:
(أ) باستخدام طريقة موهر Mohr’smethod
(ب) باستخدام طريقة فاجان Fajan’smethod
Determination of Normality and Strength of AgNO3 by standard solution NaCl of by using Mohr’s and Fajan’s Methods
أولاً/ معايرة محلول نترات الفضة باستخدام كرومات البوتاسيوم كدليل (طريقة موهر)
الأساس النظري
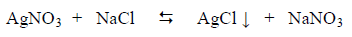
المواد اللازمة
خطوات العمل
ثانياً/ معايرة محلول نترات الفضة باستخدام أدلة الإدمصاص (طريقة فاجان)
الأساس النظري لطريقة فاجان
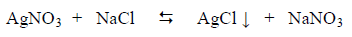
المواد اللازمة
خطوات العمل
طريقة الحساب
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة الآتي:
1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به.
2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها ، كما لا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض.
3) يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف.
4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها.
5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط.
6) يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات، كما يجب الانتباه عند تغطية زجاجات الكيماويات.
7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها ، واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلامة.
8)عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي .
تعليمات أخري
9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط ، بلل الزجاج بالماء أو الزيت أولاً لان ذلك يسهل ألي حد كبير هذه العملية.
10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه .
11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر. كما يجب مراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء.
12) يجب أن يكون بكل مختبر أكثر من مخرج وكما يفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج.
13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يوميا ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة
14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه.
15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر.
16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وان تكون مزودة بمروحة سحب مناسبة.
المراجع : الكيمياء التحليلية الكمية (التحليل الجحمي والوزني) / الجزء العملي للفصل الدراسي الثاني للفرقة الثانية كيمياء/ جامعة الملك عبد العزيز كلية التربية للبنات بجدة/ تأليف د. ريم محمد الغانمي أستاذ الكيمياء التحليلية المساعد ؟ 1429 – 1430 هـ / السعودية