معايرات تكوين المعقدات (المتراكبات) التي تستخدم فيها الأديتا EDTA
(1) يعتبر EDTA حمضاً عضوياَ ضعيفاَ وهو من أهم عوامل التعقيد المستخدمة في المعايرات التى تتضمن تكون معقد وذلك لأنه يكون معقدات كلابية Chelating complexs مع عدد كبير من الفلزات باستثناء الفلزات القاعدية.
(2) بما أن EDTA سداسي الأسنان فإنه دائماً يتفاعل مع أيونات الفلزات بنسبة 1:1
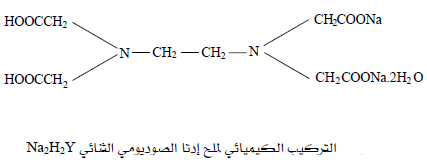
(3) الحمض الحرH4Y عديم الذوبان فى الماء ولكن ملحه الصوديومي الثنائي Na2H2Y يذوب في الماء ولذلك فهو الأكثر استعمالاً في تحضير محاليل EDTA القياسية.
تأثير الرقم الهيدروجيني على معايرات EDTA
– يلاحظ أنه أثناء معايرات أيونات الفلزات مع محلول قياسي مع الملح الصوديومي الثنائي لـ EDTA تتحرر أيونات الهيدروجين:
لهذا فأنه لابد من إضافة محلول لمنع تغير الرقم الهيدروجينى أثناء المعايرة حيث يثبت الرقم الهيدروجينى عند الرقم المناسب وذلك حسب نوع الأيون الفلزي المعاير لأن ثبات المركبات المعقدة للإديتا يعتمد على:
(1) نوع الأيون الفلزي
(2) الرقم الهيدروجيني pH
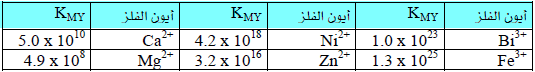
– يوضح الجدول التالي ثبات معقدات إدتا KMY مع بعض أيونات الفلزات:
– إن وجود أيونات الهيدروجين بكثرة في المحلول تضعف قوة المركب المعقد MY أي تقلل من ثباته عن طريق تفاعل الهيدروجين مع الأنيون Y الذي يقل تركيزه في المحلول نتيجة ذلك.
أي أن أيونات الهيدروجين تنافس أيونات الفلز على الارتباط بالأيون Y ومن هذا نستنتج الآتي:
(أ) الوسط القاعدي يناسب معايرة بعض الأيونات الفلزية مثل الكالسيوم والماغنسيوم التي تكون مركبات معقدة ضعيفة مع إديتا حيث أنه في هذا الوسط لا توجد منافسة من أيونات الهيدروجين.
(ب) وسط متوسط الحمضية يناسب معايرة الخارصين والنيكل حيث أن ايونات الهيدروجين في هذه الحالة لن تؤثر كثيراً بسبب قوة المعقد.
(جـ) الأوساط الأكثر حموضية يناسب معايرة Fe+3 , Bi+3 حيث أن الهيدروجين لا تؤثر على هذه الأيونات.
لهذا نجد أن معايرات إديتا كلها تعتمد على استعمال المحاليل المنظمة Buffer solutions لجعلها انتقائية.
أدلة معايرات المركبات المعقدة indicators Complexmetric titration
الأدلة الشائعة الاستعمال في معايرات EDTA هي الأدلة الفلزية وهى عبارة عن أصباغ أو مواد عضوية ملونة تتفاعل مع بعض أيون الفلزات لتعطى مركبات معقدة ذات لون يختلف عن لون الدليل نفسه.
خصائص أدلة معايرات المركبات المعقدة
(1) مركبات صبغية قابلة للذوبان في الماء.
(2) مركبات لها المقدرة لتكوين مركبات معقدة مع أيون الفلز.
(3) المركب المعقد المتكون بين الدليل والفلز يختلف لونه عن لون الدليل الحر.
(4) ثابت المركب المعقد (إدتا – الفلز) أعلى بكثير عن ثابت المركب المعقد (الدليل – الفلز).
أمثلة للأدلة المستخدمة فى معايرات المركبات المعقدة
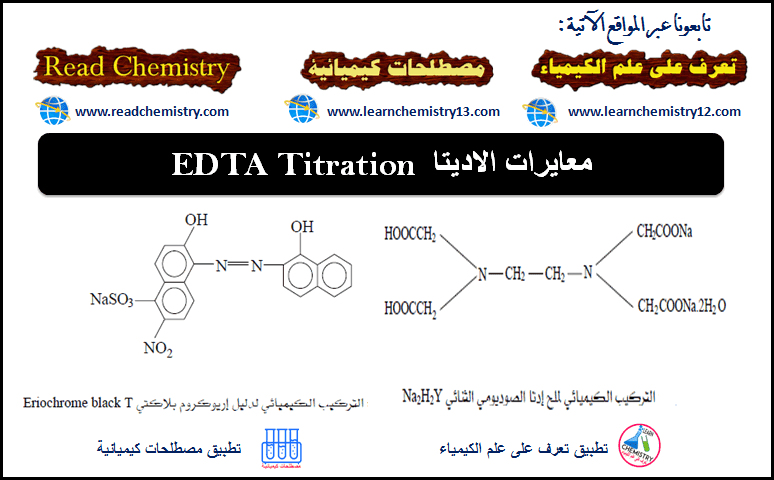
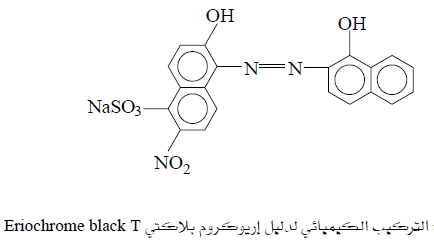
(أ) أريوكروم بلاك تي Eriochrome black T
– يسمى هذا الدليل مختصراً بــ Erio-T
– رمزه الكيميائي NaH2D
– يمكن تمثيل اتزان هذا الدليل كالآتي:
(ب) دليل الميروكسيد Murexide indicator
– دليل الميروكسيد عبارة عن ملح أمونيوم لحمض البربيوريك Ammonium salt of purpuric acid
– لون هذا الدليل يعتمد على الرقم الهيدروجيني وهكذا:
– هذا الدليل يعطى معقداً ذا لون وردي محمر مع الكالسيوم بينما لا يعطي أى لون مع الماغنسيوم لذلك فإنه يناسب تحديد تركيز الكالسيوم في خليط يحتوى على الماغنسيوم.
(جـ) أدلة أخرى
كالمقايت Calmagite – كالسيكروم Calcichrome – البيروكاتيكول البنفسجي Pyrocatechol Violet – ميثيل الثيمول الأزرق – الزنكون .Zincon
طريقة عمل الدليل
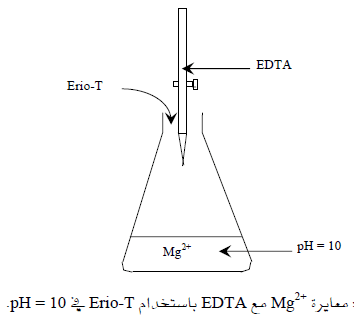
للتوضيح لنأخذ مثلاً معايرة Mg2+ مع EDTA باستخدام Erio-T فى pH = 10
(1) قبل بدء معايرة وعند إضافة Erio-T إلى الدورق سوف يتلون المحلول باللون الأحمر بسبب التفاعل التالي:
(2) إثناء المعايرة يتفاعل إديتا المضاف من السحاحة مع Mg2+ (الغير متفاعل مع Erio-T)
(3) عند نقطة التكافؤ سوف يتفاعل إديتا ذو ثابت الأتزان الأعلى مع المركب MgIn–
تحول اللون من الأحمر إلى الأزرق يعنى أنتهاء المعايرة.
أنواع معايرات الأديتا Types of EDTA Titration
(1) المعايرة المباشرة Direct Titration
– في هذه الطريقة يتم أولاً تثبيت الرقم الهيدروجينى للمحلول الذي يحتوي على أيون الفلز عند الرقم المطلوب وذلك باستخدام محلول منظم معين.
وبعد ذلك يعاير هذا المحلول مباشرة بواسطة محلول قياسي من EDTA في وجود الدليل المناسب.
– الأيونات التى يمكن معايرتها بهذة الطريقة هي أيونات الفلزات التى:
(أ) يوجد لها دليل مناسب
(ب) تتفاعل مع EDTA بسرعة
(2) المعايرة الخلفية Back Titration
– كثير من أيونات الفلزات لا يمكن معايرتها بالطريقة المباشرة لعدة أسباب منها:
(1) قد تترسب هذه الأيونات عند الرقم الهيدروجيني المطلوب للمعايرة على هيئة هيدروكسيدات.
(2) قد تترسب مع بعض الآنيونات تحت هذة الظروف.
(3) تفاعلها مع EDTA يكون بطيئاً كما في حالة الألومنيوم.
(4) عدم توفر دليل مناسب للفلز.
– في تلك الحالات يضاف إلى محلول الأيون كمية زائدة من EDTA ثم يثبت الرقم الهيدروجيني وبعد ذلك تعاير الكمية الزائدة من EDTA في وجود الدليل Erio-T
❒ مثال للمعايرات الخلفية
الزركونيوم Zr4+ يتفاعل مع إدتا ببطء لذا يتم تقديره بواسطة إدتا بالمعايرة الخلفية.
مثال: تمت إضافة 10 مل من محلول إدتا القياسي ) 0.0502 مولار) إلى محلول يحتوي على الزركونيوم Zr4+ بعد تمام التفاعل تمت معايرة الكمية الزائدة من إديتا بمعايرة خلفية باستخدام البزموث القياسي (تركيزه 0.0502 مولار) فإذا كان حجم البزموث عند نقطة التكافؤ يساوي 2.08 مل احسب عدد ملليميترات millimoles الزركونيوم ، ثم احسب تركيزه بالملجم.
الحل:
معادلة التفاعل قبل المعايرة الخلفية:
لأن نسبة التفاعل 1:1 فيمكن كتابة الآتي:
التركيز بالملجم:
(3) معايرات المخاليط Mixure Titration
إديتا يعتبر عامل غير انتقائي لأن يكون مركبات معقدة مع أعداد كبيرة مع أيونات الفلزات ولكي يصبح انتقائياً يمكن اتباع أحد الطرق التالية:
(أ) التحكم في الرقم الهيدروجيني
فمثلاً خليط يحتوي على Bi , Pb يمكن معايرتها دون تداخل أحداهما على الآخر وذلك بضبط الرقم الهيدروجيني على pH = 2 ويعاير Bi (البزموث) ثم يتم ضبط الرقم الهيدروجيني إلى pH = 5 ويتم معايرة Pb
(ب) استعمال عوامل الحجب واللاحجب Masking and demasking agents
يستعمل مثلاُ عامل الحجب أيون السيانيد Cyanide ion, CN– حيث أن CN– يكون مركبات ثابتة مع Co, Cu, Hg, Zn, Cd, Ni ولكن لا يحجب (لايتفاعل) أيونات مثل Pb, Mg
فإذا كان لدينا خليطاً يحتوي على Co , Mg يضاف للخليط CN– فيتفاعل مع Co (يحجب Co)
ثم يعاير Mg بـ إديتا وبعد ذلك يضاف عامل اللاحجب مثل فورمالدهيد Formaldehyde, HCHO ثم يعاير Co مع محلول إديتا.
(4) المعايرة بالإحلال Displacement Titration
في معايرات الإحلال تضاف كمية زائدة من محلول متراكب الـ EDTA مع معدن مثل الزنك أو المغنيسيوم
وذلك عندما يستطيع المعدن المراد تقديره أن يكون متراكباً أكثر ثباتاً مع الـ EDTA من متراكب الزنك أو المغنيسيوم وبهذا فسوف يحل المعدن المراد تقديره محل المغنيسيوم أو الزنك حسب التالي:
ويقدر المغنيسيوم الناتج من الإحلال بواسطة محلول قياسي من الـ EDTA وهذه الطرق مفيدة أيضاً عند عدم توفر دليل يمكن استخدامه للعنصر المراد تقديره كما هو الحال بالنسبة لتقدير الكالسيوم الذي يعطي نقطة تكافؤ غير واضحة.
(5) المعايرة بقياس القلوية Alkalimetric Titration
في هذه الطرق يضاف زيادة من محلول EDTA الثنائي الصوديوم إلى محلول متعادل تماماً من أيون المعدن المراد تقديره فيتكون متراكب الـ EDTA مع أيون المعدن وتتحرر كمية من أيوناتالهيدروجين المكافئة لأيون المعدن.
ومن ثم تعاير أيونات الهيدروجين المتحررة بمحلول قاعدة قياسي باستخدام أدلة التعادل.
(6) معايرة الأيونات السالبة Titration of Anions
بالرغم من أن الأيونات السالبة لا تستطيع تكوين متراكبات مع الــ EDTA الإ أنه يمكن تقديرها بطريقة غير مباشرة وذلك بإضافة كمية زائدة ومعلومة من محلول قياسي لأيون موجب مناسب ثم معايرة الزيادة من الأيون الموجب بواسطة محلول قياسي للـ EDTA
فمثلاً تقدر الكبريتات بترسيبها وذلك بإضافة كمية زائدة ومعلومة من محلول الباريوم القياسي ثم معايرة الزيادة من الباريوم بواسطة محلول قياسي للـ EDTA وكذلك يمكن تقدير السيانيد والفوسفات بإضافة كمية زائدة ومعلومة من محلول المغنيسيوم القياسي إليها ثم تعاير الزيادة من المغنيسيوم بمحلول قياسي من الـ EDTA
المراجع:
– كتاب اساسيات الكيمياء التحليلية (تخصص مختبرات كيميائية 165 كيم) / المؤسسة العامة للتدريب التقنى والمهنى / السعودية / طبعة 1429م .
– محاضرات الكيمياء التحليلية (التحليل الحجمى والوزني) / خيرية محمد عبدالله الأحمري /(1430 – 1429 هـ ) / جامعة الملك عبد العزيز- المملكة العربية السعودية.
– كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها.
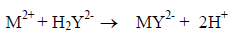
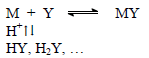
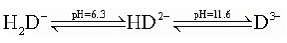
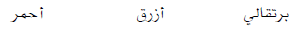
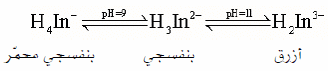
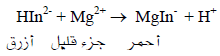
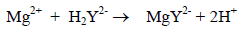
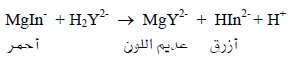


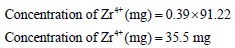
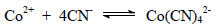








بوركتم وين رابط التحميل
عمل رائع جدا جزاكم الله خيرا