قانون التخفيف للمحاليل Dilution Law + قوة المحلول (Strength (S

أولاً/ قانون التخفيف Dilution Law
– قانون التخفيف أحد أهم القوانين الأكثر استخداماً في معمل الكيمياء التحليلية.
– تتم عملية تخفيف المحاليل بإضافة المزيد من المذيب إلى محلول ذي تركيز معين.
– وبالتالي فإن تركيز المحلول يقل بسبب زيادة الحجم، إلا أن كمية المذاب تظل كما هي قبل وبعد التخفيف.
– وبالتالي فعدد المولات قبل التخفيف يساوي عدد المولات بعد التخفيف.
– ونعلم أن عدد المولات يحسب من حاصل ضرب التركيز بالمولارية (M) في حجم المحلول باللتر أو بالمللتر.
– لذك فأن المعادلة الرياضية لقانون التخفيف كما يلي:
حيث:
M1 : تركيز المحلول الابتدائي (قبل التخفيف)
M2 : تركيز المحلول النهائي (بعد التخفيف – يعد إضافة مزيد من المذيب)
V1 : حجم المحلول الابتدائي (قبل التخفيف – قبل إضافة المذيب)
V2 : حجم المحلول النهائي\(بعد التخفيف – بعد إضافة المذيب)
ثانياً/ أمثلة محلولة على قانون التخفيف
مثال (1): عند تخفيف 250 ml من حمض الكلور المركز الذي تركيزه 11M إلي حجم قدره 500 ml فكم يكون التركيز بالمولارية للمحلول النهائي؟
الحل:
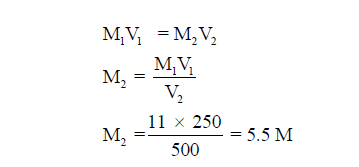
مثال (2): أراد كيميائي تخفيف 50 ml من (3.5M H2SO4) إلي (2M H2SO4) فإلي أي حجم يجب أن يخفف؟
الحل:
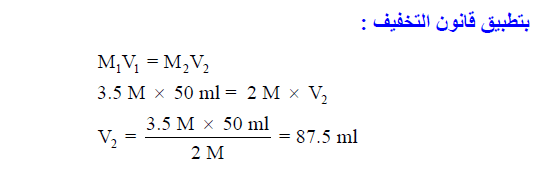
مثال (3): 50 ml من محلول معين تركيزه 0.2 M أضيف إليه كمية من الماء حجمها 20 ml . أحسب المولارية للمحلول الجديد؟
الحل:

مثال (4): إذا كان لدينا 250 mlمن محلول تركيزه 1.25 M فكم حجم الماء الذي يلزم إضافته لتكوين محلول تركيزه 0.5 M؟
الحل:

مثال (5): احسب حجم ووزن هيدروكسيد الصوديوم NaOH المركز الذي تركيزه 80% وكثافته 1.42 g/ml الذي يلزم لتحضير 200 ml من المحلول الذي يبلغ تركيزه 8 M ؟
علماً بأن الكتل الذرية : (H = 1, O = 16, Na = 23)
الحل:


مثال (6): 0.5 L من HClO4 الذي تركيزه 2.5 أضيف إليه 0.8 L من HClO4 الذي تركيزه 3.7 Mوخفف المحلول حتى أصبح حجمه 6.31 L ما مولارية المحلول الناتج؟
الحل:
مثال (7): احسب التركيز النهائي لمحلول حمض الكبريت H2SO4 إذا كان المحلول ناتج عن مزج 50 ml من (0.5 M H2SO4) مع 75 ml من (0.25 M H2SO4) ؟ افرض أن الحجم النهائي للمزيج 125 ml
الحل:
في ھذه الحالة تم التخفیف لكن صاحبته زیادة في عدد المولات لأن الإضافة ھنا إضافة محلول ولیست إضافة مذیب، لذلك فإننا نوجد عدد مولات الحمض في كلا المحلولین ثم نجمع ھذه المولات كما یلي:


مثال (8): كم مللتراً من الماء يجب أن تضاف إلى 250 ml من محلول حمض الكبريتيك (H2SO4) الذي تركيزه (19.6%) وزناً ، وكثافته 1.96 g/ml لكي نحصل على محلول تركيزه 2 M؟
علماً بأن الكتل الذرية : (H = 1, O = 16, S = 32.1)
الحل:



ثالثاً/ قوة المحلول Strength (S)
– قوة المحلول هي عدد الجرامات المذابة الموجودة في لتر من المحلول.
– ويمكن صياغتها رياضياً بالقانون:
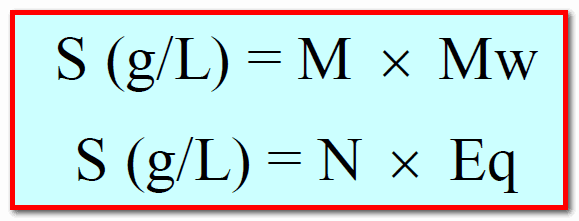
رابعاً/ أمثلة محلولة على قانون قوة المحلول (S)
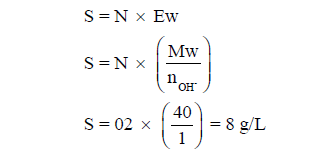
مثال (2): محلول حمض الكبريتيك H2SO4 تركيزه 0.5 M فاحسب قوة المحلول (S)؟
علماً بأن الكتل الذرية : (H = 1, O = 16, S = 32)
الحل:
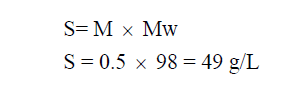
مثال (3): إذا أذيب 25 g من نترات الفضة AgNO3 في 150 g من الماء، فإذا أصبح حجم المحلول 130ml ، فاحسب قوة المحلول (S)؟
علماً بأن الكتل الذرية : (N = 14, O = 16, Na = 108)
الحل:
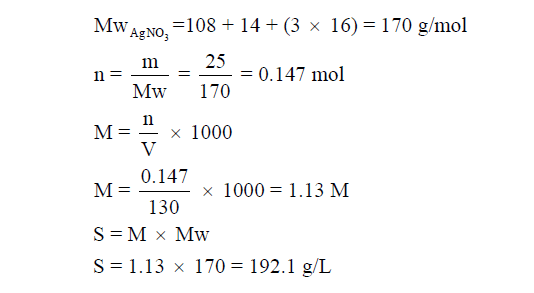
المراجع : قانون التخفيف للمحاليل Dilution of solution ، قوة المحلول (Strength (S – الفصل الأول / طرق التعبير عن التركيز من كتاب أسس الكيمياءالعامة والفيزيائية للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء كلية العلوم -جامعة أم القري.








ممتاز جدا هذه تعتبر ثروة اسال الله ان يجعله في ميزان حسناتكم
شكراً جزيلا لك على هذا الدعم
كنز هالموقع
رائع
شكراً لهذا الشرح المفصل