أنواع الأدلة فى معايرات التعادل Neutralization Indicators
– أن أنواع الأدلة في معايرات التعادل عديدة ولكن سنقوم بتقسيمها إلى أربع أنواع رئيسية.
محتويات الموضوع
أنواع الأدلة فى معايرات التعادل Neutralization Indicators
– تعرف أدلة التعادل Neutralization Indicators أيضاً بأدلة الأحماض والقواعد (Acid base indicators).
– وهي عبارة عن مركبات عضوية ضعيفة التأين تسلك فى المحاليل سلوك الأحماض أو القواعد.
– تعتمد ألوانها على الرقم الهيدروجيني للمحلول. أي على تركيز ايون الهيدروجين الذي يحدث له تغير كبير مفاجئ عند نقطة التكافؤ، ويتبع ذلك تغير في لون الدليل.
– كما يتغير لون كل دليل في منطقة معينة من الرقم الهيدروجيني pH
– يتوقف ذلك على ثابت التأين للدليل ولا يعتمد إطلاقاً على نوع القاعدة أو الحمض الداخلين فى التفاعل.
– تنقسم أنواع الأدلة في معايرات التعادل Neutralization Indicators إلى الأقسام الآتية كما يلي:
(1) الدليل البسيط Simple Indicator
(2) الدليل المستور Screened Indicator
(3) الدليل المختلط Mixed Indicator
(4) الدليل العام Universal Indicator
(1) الدليل البسيط Simple Indicator
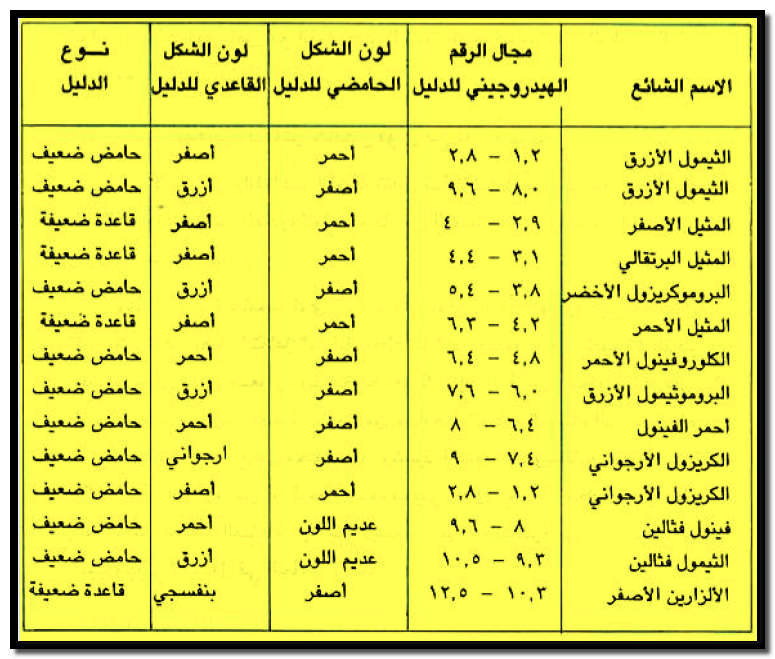
– يتكون الدليل البسيط من مادة واحدة يتغير لونها فى مجال محدد للرقم الهيدروجيني.
– من الأمثلة على الأدلة البسيطة هي كما يلي:
- دليل الميثيل البرتقالي
- الفينول فثالين
- عباد الشمس
– الجدول التالي يبين الأدلة البسيطة وألوانها ومجال الرقم الهيدروجيني الذي تتغير فيه لون الدليل كما يلي:
(2) الدليل المستور Screened Indicator
– الدليل المستور هو أحد أنواع الأدلة في معايرات التعادل Neutralization Indicators
– هناك بعض التفاعلات التي لا يمكننا فيها أن نلمس التغير فى لون الدليل بالعين المجردة عند الانتقال من الصورة الحامضية إلى الصورة القاعدية أو بالعكس حيث أن أطوال الموجات التي يمتصها الدليل تتداخل مع أطوال الموجات التي يمتصها المحلول.
– كما يمكن تحسين ظهور لون الدليل بإضافة صبغة حساسة لتغيرات الرقم الهيدروجيني ولونها يتمم أحد ألوان الدليل غير المتداخل مع لون المحلول.
– وعلى ذلك فأن الدليل المستور هو عبارة عن دليل بسيط مضافاً إليه صبغة ما تجعل التغير فى اللون أكثر وضوحاً عند نقطة التعادل أو عند نقطة التعادل.
– وبالرغم من أن تغير اللون عند نقطة التعادل قد يختلف كلياً عنه عند استخدام الدليل البسيط نفسه فقط، إلا أن مجال الرقم الهيدروجيني الذي يحدث خلاله التغيير لا يتأثر إطلاقاً.
– مثال على ذلك إضافة سيانول الزايلين Xylenecyanol F-F إلى الميثيل البرتقالي بنسبة 1.4 جم من الصبغة إلى 1 جم من الدليل في 500 مل من محلول 50% كحول.
– حيث يتحول اللون من الأخضر في الطرف القاعدي إلى اللون الرمادي فى الطرف الحامضي عند الرقم الهيدروجيني 3.8
– كما يدعى هذا المزيج أحياناً باسم الميثيل البرتقالي المستور Screened methyl Orange.
(3) الدليل المختلط Mixed Indicator
– نحتاج في بعض المعايرات إلى دليل يتغير لونه في مدى ضيق من الرقم الهيدروجيني للمحلول pH
– وفي هذه الحالة لا يمكن استخدام الأدلة البسيطة حيث أن التغير في اللون يحتاج إلى مدى من الرقم الهيدروجيني يبلغ وحدتين من وحدات الرقم الهيدروجيني.
– وفي هذه الحالة يجب استعمال مزيج من الأدلة تكون ثوابت تفككها متقاربة جداً من بعضها، وبذلك يحدث تداخل فى اللون عند القيمة المطلوبة من الرقم الهيدروجيني.
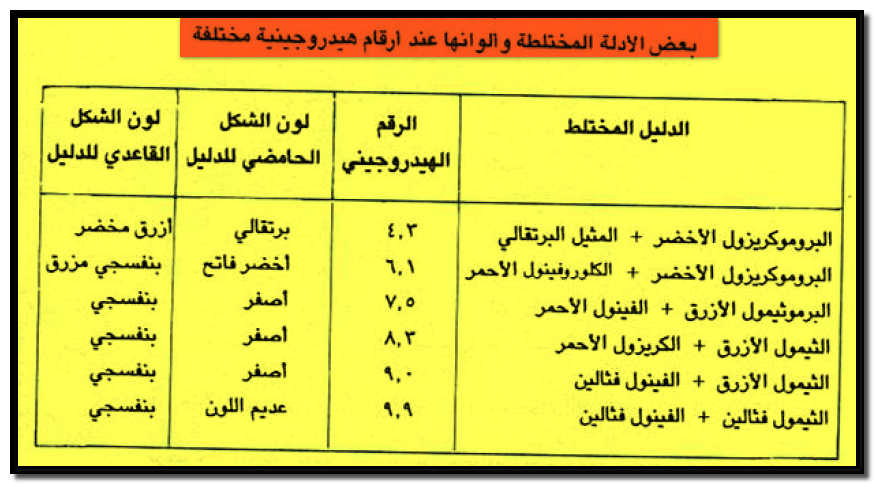
– مثال على ذلك خليط من الثيمول الأزرق Thymol Blue والكريزول الأحمر Cresol red حيث يحدث تغير فى اللون من الأصفر إلى البنفسجي عند الرقم الهيدروجينيpH=3.8 .
– كمثال آخر مزيج من دليل الميثيل الأخضر والفينول فثالين فى الكحول بنسبة 2% و 1% على التوالي حيث يكمل الميثيل الأخضر اللون الأحمر البنفسجي للصورة القاعدية للفينول فثالين. ويتغير لون الدليل من الرمادي إلى الأزرق في مجال الرقم الهيدروجيني من 8.4 – 8.8 .
– الجدول التالي يبين بعض الأدلة المختلطة والرقم الهيدروجيني pH الذي يتغير عنده لون هذه الأدلة كما يلي:
(4) الدليل العام Universal Indicator
– الدليل العام هو آخر أنواع الأدلة فى معايرات التعادل Neutralization Indicators
– نحصل علي هذا النوع من الأدلة بواسطة مزج عدة أدلة بنسبة معينة لاستخدامه في مدى واسع من الرقم الهيدروجيني.
– كما تسمى هذة الأدلة في بعض الأحيان بالأدلة متعددة المراحل Multiple range indicators
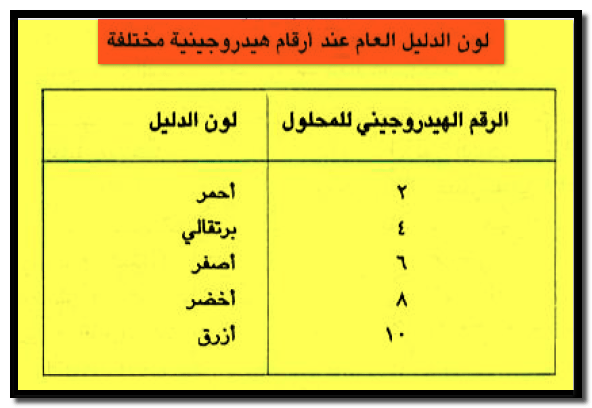
– هذه الأدلة تغير لونها عدة مرات حيث يظهر كل لون عند رقم هيدروجيني معين ولا يستحسن استخدامه في المعايرات الكمية ولكنه يستخدم في تعيين الرقم الهيدروجيني التقريبي للمحلول بطريقة مقارنة الألوان.
– مثال على ذلك الدليل المحضر بإذابة 0.1 جم من الفينول فثالين و0.2 جم من الميثيل الاحمر و0.3 جم من الميثيل الاصفر و 0.4 جم من البروموثيمول الأزرق و0.5 جم من الثيمول الأزرق في500 مل من الكحول الذي يحوي كمية كافية من هيدروكسيد الصوديوم حتى يصبح اللون أصفراً.
– يبين الجدول التالي لون هذا الدليل العام عند أرقام هيدروجينية مختلفة كما يلي:
المراجع : أدلة التعادل Neutralization Indicators. الفصل الثاني (أسس التحليل بالمعايرة) من كتاب التحليل الكيميائي الكمي التقليدي لطلاب الكليات والجامعات. من تأليف : أ.د/محمد أحمد آشي ، أ.د/ عبد الغني حمزة ، د/ توفيق عميرة ، د/ عبد العزيز السباعي ، د/ أحمد عشي .








جزاكم الله خير الجزاء و أسكنكم الفردوس إن شاء الله
موقع مفيد للغاية