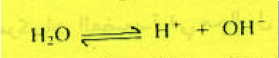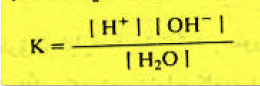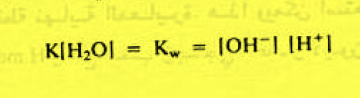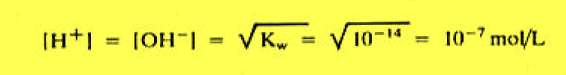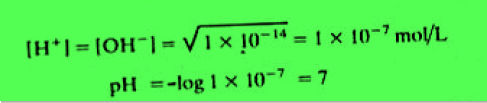تفكك الماء – اشتقاق القانون pH + pOH =14
– في هذا الموضوع سيتم مناقشة تفكك الماء Dissociation of water – اشتقاق القانون pH + pOH =14 وكذلك أهم القوانين المتعلقة بالموضوع.
محتويات الموضوع
تفكك الماء Dissociation of water
– تعتمد جميع تفاعلات التعادل في المحاليل المائية على اتحاد أيونات الهيدروجين مع أيونات الهيدروكسيل لتكوين الماء.
– يتأين الماء بدوره إلى أيونات الهيدروجين والهيدروكسيل على النحو الآتي كما يلي:
– وبتطبيق قانون فعل الكتلة فإن ثابت التأين والذي يرمز له بـ K يعطى بالعلاقة كما يلي:
اشتقاق القانون pH + pOH =14
– يكون ثابت التأين للماء مساوياً K = 1.8 × 10-16 عند درجة الحرارة 25 Co
– وحيث أن تركيز الماء فى المحاليل المخففة كبير جداً بالنسبة لتركيز المذيبات الأخرى ، لذا يمكن اعتبار أن تركيز الماء ثابتاً ومساوياً لتركيزه في الماء المقطر أي 1000/18 ويساوي 55.5 مول/لتر ولا يتغير هذا التركيز بصورة ملحوظة إلا فى التراكيز المرتفعة.
– ويمكن دمج تركيز الماء الثابت في ثابت التأين فتصبح العلاقة كما يلي:
– يسمى الثابت Kw ثابت الحاصل الأيوني للماء وتساوي قيمة عند 25 Co كما يلي:
Kw = 1.8 × 10-16 × 55.5
= 1 × 10-14
– وحيث أن تفكك الماء هو تفاعل ماص للحرارة فإن ثابت الحاصل الأيوني للماء يزداد بارتفاع درجة الحرارة.
– فعند درجة حرارة 60 Co فإن قيمة ثابت الحاصل الأيوني للماء مساوية 1 × 10-13 وفي درجة حرارة 100 Co تكون قيمته مساوية 4.9 × 10-13
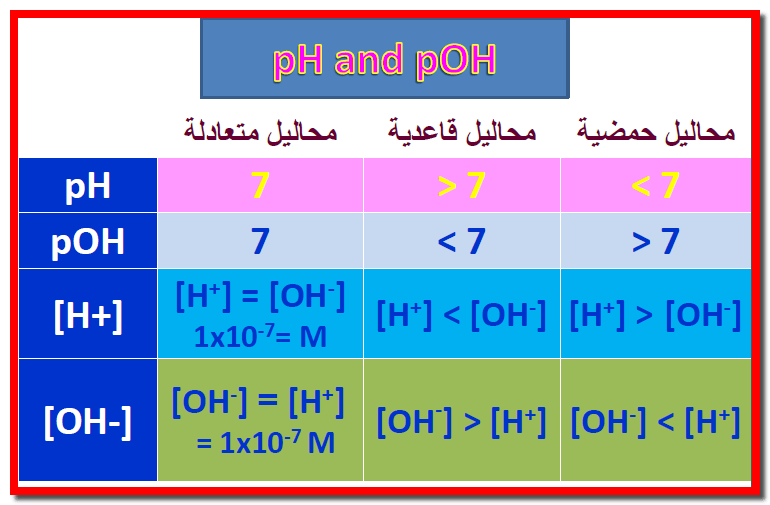
– وفي الماء النقي وعند درجة حرارة 25 Co يكون تركيز أيون الهيدروجين مساوياً لتركيز أيون الهيدروكسيد كما يلي:
– إذا زاد تركيز ايونات الهيدروجين عن تركيز ايونات الهيدروكسيل فإن المحلول يكون حامضياً.
– إذا زاد تركيز ايونات الهيدروكسيل عن تركيز أيونات الهيدروجين فأن المحلول يكون قاعدياً.
– وإذا تساوي تركيز أيونات الهيدروجين مع تركيز ايونات الهيدروكسيل فأن المحلول يكون قاعدياً كما يلي:
وبأخذ اللوغاريتم السالب لطرفي معادلة ثابت الحاصل الأيوني للماء نحصل على المعادلة الآتية كمايلي:
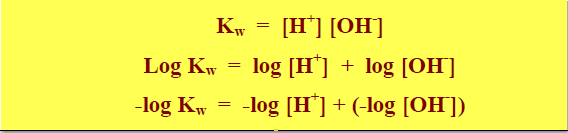
– وبما أن – log = p فأن المعادلة تصبح كما يلي:
pkw = pH + pOH
– وحيث أن Kw = 1 × 10-14 عند درجة 25 Co وبأخذ اللوغاريتم السالب للطرفين فأن pkw = 14 ومنها نحصل على المعادلة المهمة جداً كما يلي:
– تجب الملاحظة أن القيمة العددية لثابت الحاصل الأيوني للماء لا تتغير بإضافة حمض أو قاعدة، ولكن تتغير فقط التراكيز الجزيئية لأيونات الهيدروجين والهيدروكسيل بحيث يبقى حاصل ضربها ثابتاً ويساوي Kw
قوانين مهمة عن تفكك الماء
– يمكن تلخيص القوانين السابقة كما يلي:
مسائل محلولة على تفكك الماء
مثال: احسب تركيز أيون الهيدروجين والرقم الهيدروجينى للماء النقي عند الدرجة 25 Co وعند الدرجة 100 Co ؟
الحل:
– أن كل أيونات الهيدروجين والهيدروكسيل الموجودة فى الماء النقي ناتجة من تفكك الماء ولهذا فإن تراكيزها تكون متساوية.
– ويمكن حسابها من ثابت التاين الحاصل الأيوني للماء الذي يساوي 1 × 10-14 عند درجة حرارة 25 Co ويساوي 4.9 × 10-13 عند درجة حرارة 100 Co
(a) At 25 Co :
(b) At 100 Co:
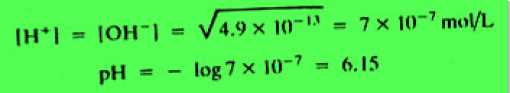
(1418 – 1997) المراجع : التحليل الكيميائي الكمي التقليدي لطلاب الكليات والجامعات . محمد أحمد آشى- عبد الغني حمزة – توفيق عميره – عبد العزيز حمزة – عبد العزيز السباعي – أحمد عشي ، الطبعة الثانية