تعيين تركيز ھيدروكسيد الصوديوم NaOH بمعايرته بحمض الهيدروكلوريك
فكرة تجربة تعيين تركيز ھيدروكسيد الصوديوم NaOH
تھدف ھذه التجربة إلى تعيين تركيز محلول ھيدروكسيد الصوديوم وذلك بمعايرته مع محلول كاشف من حمض الهيدروكلوريك القياسي معلوم التركيز (0.1N) حيث يتفاعل ھيدروكسيد الصوديوم مع حمض الهيدروكلوريك وفقاً للمعادلة التالية:
NaOH + HCl⎯⎯→NaCl + H2O
وعند نقطة النھاية يكون الوسط متعادلاً وباستخدام دليل الفينولفثالين فإن لونه عند ھذه النقطة يتغير من الأحمر الوردي في الوسط القاعدي إلى عديم اللون .
الأدوات والمواد المستخدمة في تجربة تعيين تركيز ھيدروكسيد الصوديوم NaOH
- دورق مخروطي سعته ( 250ml)
- ماصة سعتھا (10ml)
- سحاحة سعتھا (50ml)
- معلوم التركيز (HCl) حمض الكلور (0.1N)
- محلول ھيدروكسيد الصوديوم (NaOH) المجھول التركيز
- كأس سعة (100ml) يوضع به ھيدروكسيد الصوديوم (NaOH)
- قارورة غسيل بلاستيكية تملأ بالماء المقطر.
- دليل الفينولفثالين (ph. ph)
- دليل الميثيل البرتقالي (M.O)
خطوات تجربة تعيين تركيز ھيدروكسيد الصوديوم NaOH
(1) اغسل السحاحة بالماء العادي ثم بالماء المقطر مرتين أو ثلاثاً ثم اغسلھا بمحلول حمض الھيدروكلوريك (HCl)
(2) املأ السحاحة مستخدماً قمع بحمض الھيدروكلوريك (HCl) ذو التركيز (0.1N) حتى يصل الحمض أعلاھا ثم افتح صمام التحكم السفلي بالسحاحة لإنزال مستوى الحمض بالسحاحة حتى العلامة صفر .
(3) اغسل دورقاً مخروطياً سعته ( 250ml) بالماء العادي ثم بالماء المقطر.
(4) اغسل ماصة سعتھا ( 10ml) بالماء المقطر ثم بمحلول ھيدروكسيد الصوديوم (NaOH)
(5) اسحب( 10ml) من محلول ھيدروكسيد الصوديوم (NaOH) بالماصة ثم ضعھا بالكامل في الدورق المخروطي. وإذا بقي شيء من المحلول في نھاية الماصة فاحرص على إنزاله في الدورق برطم نھايتھا برفق بقاع الدورق المخروطي.
(6) أضف قطرتين أو ثلاثاً من دليل الفينولفثالين(ph.ph)على المحلول بالدورق المخروطي (محلول NaOH) لتحصل على اللون الأحمر الوردي.
(7) ابدأ المعايرة بإضافة حمض الھيدروكلوريك (HCl) الموجود بالسحاحة تدريجياً إلى محلول ھيدروكسيد الصوديوم (NaOH) الموجود بالدورق المخروطي مع رج الدورق المخروطي باستمرار أثناء المعايرة.
وعند نقطة النھاية (end point) وھي النقطة التي يتفاعل عندھا جميع ھيدروكسيد الصوديوم في الدورق المخروطي مع الحمض وفقاً للتفاعل التالي
NaOH + HCl⎯⎯→NaCl + H2O
فإن الدليل يصبح لا لون له. وعند الحصول على ھذا التغير في اللون نوقف المعايرة على الفور.
باقي خطوات التجربة
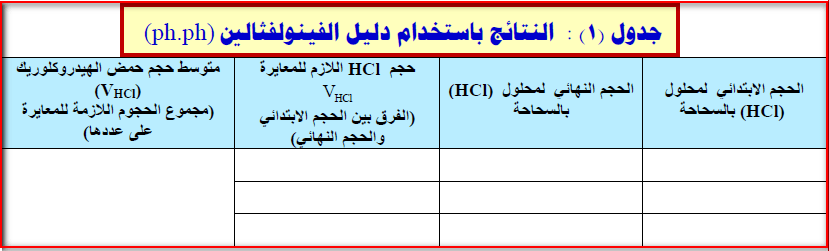
(8) سجل حجم محلول حمض الھيدروكلوريك (HCl) الذي عايرت به القاعدة .
(9) تخلص من المحلول الموجود في الدورق المخروطي واغسله بالماء المقطر، ثم خذ ( 10ml) جديدة من القاعدة (NaOH) وأضف إليھا قطرتين أو ثلاثاً من دليل الفينولفثالين ثم ابدأ المعايرة من جديد حتى تصل إلى نقطة النھاية وسجل ھذه القراءة.
(10) كرر الخطوة السابقة (خطوة 9) مرة ثالثة ثم سجل حجم الحمض الذي عايرت به.
(11) سجل حجوم الحمض التي حصلت عليھا في الفقرات (8،9،10) في جدول (1) بقسم النتائج ثم أوجد متوسط ھذه الحجوم بجمعھا ثم قسمتھا على (3).
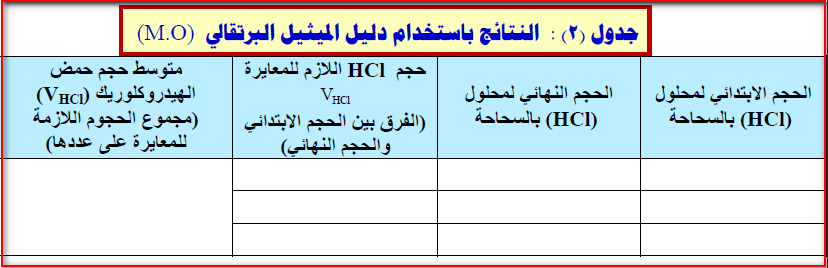
(12) تخلص من المحلول الموجود في الدورق المخروطي واغسله بالماء المقطر، ثم خذ ( 10ml) جديدة من القاعدة (NaOH) وأضف إليها قطرتين أو ثلاثاً من دليل الميثيل البرتقالي(M. O) وابدأ المعايرة حتى نقطة النھاية والتي فيھا يتحول لون دليل الميثيل البرتقالي في الوسط القاعدي من اللون الأصفر البرتقالي إلى اللون الأحمر
(13) كرر خطوة (11) مرتين وسجل حجم الحمض ثم خذ متوسط الحجم للقراءات الثلاث وسجلھا في الجدول المرفق بالنتائج (جدول 2)
النتائج والحسابات
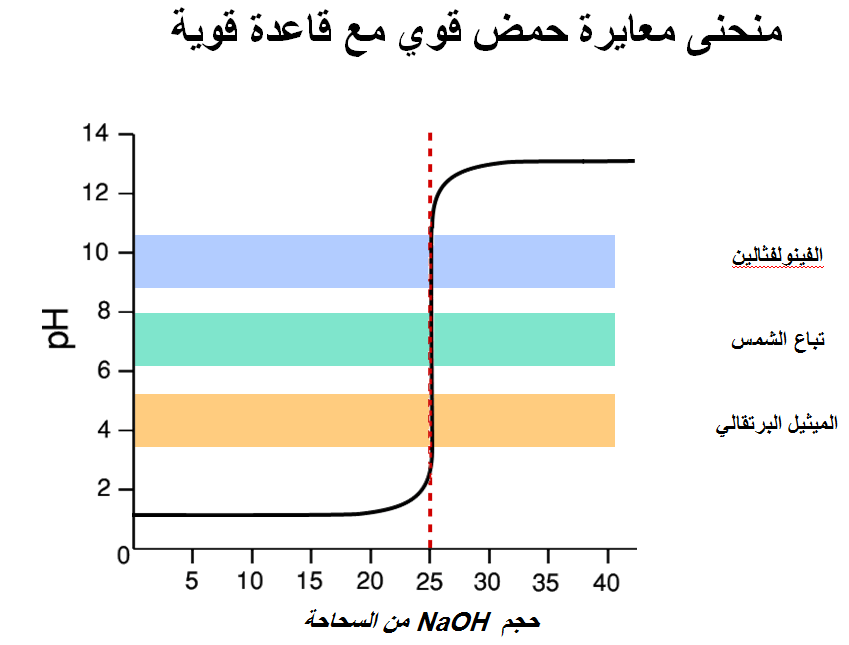
منحنى معايرة هيدروكسيد الصوديوم مع حمض الهيدروكلوريك
– هو منحني ينشأ من رسم العلاقة بين pH وحجم القاعدة وهنا لكى تكون الحسابات دقيقة.
– ويكون من السهل حساب pH للحمض فأننا نضع هيدروكسيد الصوديوم في السحاحة.








مفيد جدا
سؤال (مطلوب) ++ —– -هل هذا قياس الحموضة أو القلوية؟ (شرح) سول … • معايرة الحمض القاعدي ، حيث يتفاعل المحرف الحمضي أو الأساسي مع محلل يكون قاعدة أو حمض. قياس الحموضة هو تحديد تركيز