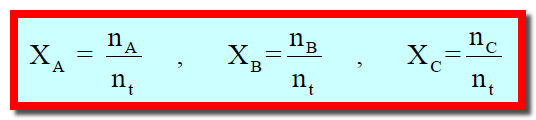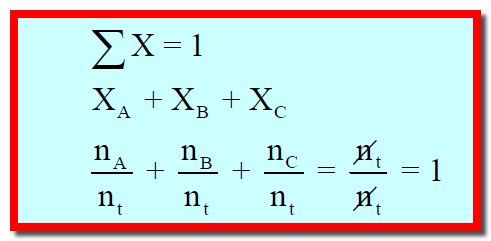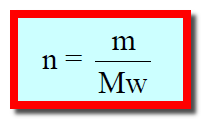الكسر المولي Mole Fraction + مسائل محلولة
الكسر المولي Mole Fraction
– الكسر المولي هو النسبة بين عدد مولات أحد مكونات المحلول (n) إلى مجموع مولات كل مكوناته (nt).
– وبفرض أن لدينا ثلاث مواد (A ,B ,C) وعدد مولات هذه المواد (nA, nB, nC) فإن الكسر المولي للمواد هو:
ومجموع هذه الكسور المولية يساوي دائماً الواحد الصحيح:
وقبل الخوض في بعض التطبيقات للكسر المولي، فإننا سنذكر فيما يلي بطرق حساب عدد المولات.
يمكن حساب عدد المولات بطرق عدة منها مايتعلق بعدد الجزئيات أو التركيز بالمولارية أو العيارية أو المولالية، إلا أن أبسط الطرق هي تحويل الجرامات بالمولارية أو العيارية أو المولالية، إلا أن أبسط الطرق هي تحويل الجرامات إلى مولات بإتباع العلاقة التالية:
حيث Mw هو عبارة عن الوزن الجزيئي المولي (molecular
weight) الذي يعرف بأنه مجموع الكتل الذرية المؤلفة للجزئ بوحدة g/mole .
مسائل محلولة على الكسر المولي Mole Fraction
مثال (1): أحسب :
أ- الوزن الجزيئي لنترات الخارصين Zn(NO3)2 إذا علمت أن :
الكتل الذرية : (Zn = 65.4, N = 14, O = 16)
ب- أحسب عدد المولات لـــ 127g من نترات الخارصين Zn(NO3)2
الحل:
مثال (2): احسب الكسر المولـي للماء H2O ، ولــــ NaCl في محلول يحتوي على 0.735 mol من كلوريد الصوديوم و 6 mole من الماء ؟
الحل:
مثال (3): ما الكسر المولي لكلوريد الصوديوم فى محلول يحتوي على 5 mol من كلوريد الصوديوم مذاب فى كيلو جرام من الماء ؟ (الكتل الذرية: H = 1, O = 16)
الحل:
نوجد عدد المولات للماء :
مثال (4): احسب الكسر المولي لحمض الفوسفور H3PO4 فى محلول يحتوي على 12.25 g من حمض الفسفور مذاب فى 90 g من الماء ؟ (علماً بأن الكتل الذرية H = 1, O = 16, P = 31 :)
الحل:
نوجد أولاً عدد المولات لكل من المذیب والمذاب ثم العدد الكلي للمولات:
تمارين أخري
مثال (5): إذا أذيب هيدروكسيد الصوديوم NaOH في الماء . احسب الكسور المولية للمذاب والمذيب في محلول تركيزه 32% وزناً؟ (علماً بأن الكتل الذرية H = 1, O = 16, Na = 23 :)
الحل:


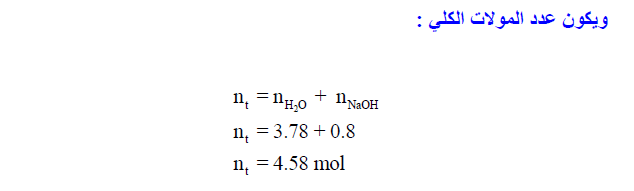
مثال (6): إذا كان الكسر المولي لملح الطعام في المحلول المائي هو 0.3 احسب النسبة المئوية الوزنية Wt% ؟ (علماً بأن الكتل الذرية: H = 1, O = 16, Na = 23, Cl = 35.5)
الحل :
لم نعط في ھذه المسألة عدد المولات للمذیب والمذاب. لذلك سنفرض أن عدد المولات الكلي للمحلول یساوي واحد، وعدد مولات ملح الطعام یساوي(nNaCl = 0.3 mol) وحینئذ فإن عدد مولات المذیب:
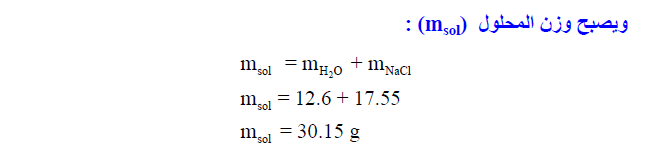
مثال (7): إذيب 19.6 من حمض الفسفور H3PO4 في كمية من الماء بحيث يصبح وزن المحلول 200 g . احسب الكسر المولي للمذاب والمذيب ؟ (علماً بأن الكتل الذرية H = 1, O = 16, P = 31 :)
الجواب النهائي : 0.98 , 0.02
المراجع : الكسر المولي Mole Fraction – الفصل الأول / طرق التعبير عن التركيز من كتاب أسس الكيمياء العامة والفيزيائية للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء كلية العلوم -جامعة أم القري.