الكيمياء التحليلية
طرق تحديد نقطة النهاية في معايرات الترسيب

معايرات الترسيب Precipitation titrations
– في هذا النوع من المعايرات والذي يسمكى بمعايرات الترسيب يكون أحد نواتج التفاعل شحيح الذوبان في الماء مكوناً راسب ويرمز لهذا الناتج عادة بسهم متجه لأسفل ↓
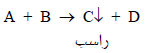
A= الكاشف ، B= المادة المراد تقديرها ، C= الراسب
فمثلاُ عند معايرة محلول الكلوريد بمحلول قياسي من نترات الفضة يتكون راسب من كلوريد الفضة.
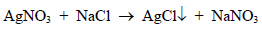
طالما أن كلوريد الفضة يترسب فأنه يخرج من التفاعل لذلك يسرع اتجاه التفاعل لليمين إلى أن يتم ترسيب الفضة على شكل كلوريد.
طرق تحديد نقطة النهاية في معايرات الترسيب
يوجد ثلاث طرق للمعايرة يستعمل فيها أيونات الفضة (طرق القياس الفضي) وتستخدم لتحديد نقطة النهاية وهذه الطرق هي:
(1) طريقة موهر Mohr’s method
(2) طريقة فولهارد Volhard’s method
(3) طريقة فاجان Fajan’s method
وسوف نشرح بإذن الله تعالى كلاً منها بالتفصيل :
أولاً/ طريقة موهر Mohr’s method
– يستخدم في هذه الطريقة دليل أيون الكرومات CrO42- Chromate ion والذي يتفاعل مع الفضة (المضاف من السحاحة) عند نقطة التكافؤ ويكون راسباً أحمر مع أول قطرة زائدة من الفضة.
– تصلح هذه الطريقة لمعايرة أيونات الكلوريد والبروميد بواسطة محلول قياسي من نترات الفضة.
– الشكل التالي يوضح طريقة موهر:
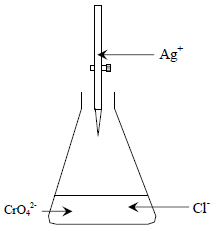
قبل نقطة التكافؤ Before end-point
قبل نقطة التكافؤ فإن أي إضافة من نترات الفضة (في السحاحة) على محلول الكلوريد مثلاً (في الدورق) يؤدي إلى ترسيب كلوريد الفضة ذات اللون الأبيض. ويترسب كلوريد الفضة أولاً بسبب أن حاصل إذابته أقل من حاصل إذابة كرومات الفضة.

عند نقطة التكافؤ At end-point
عند نقطة التكافؤ أي بعد ترسيب كل أيونات الكلوريد من المحلول فإن أول قطرة زائدة من أيونات الفضة سوف ترسب أيونات الكرومات (الدليل) على هيئة كرومات الفضة (راسب أحمر) والتي تدل على نقطة النهاية علماً بأن المعادلة رقم (1) تمثل تفاعل المعايرة والمعادلة رقم (2) تمثل تفاعل الدليل.
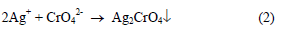
ملاحظات هامة عن طريقة موهر
يجب إنجاز هذه الطريقة في رقم هيدروجيني pH = 7-8 ولك للأسباب الآتية:
(أ) إذا كان المحلول حمضياً
يحدث التفاعل الجانبي التالي حيث يتحول الدليل إلى مادة أخرى وهي البيكرومات مما يؤدي إلى نقصان في كمية الدليل.
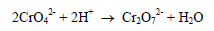
(ب) إذا كان المحلول قاعدياً
نجد أن أيونات الفضة تترسب على هيئة هيدروكسيد الفضة وهذا بالطبع يؤثر على أداء المحلول المعاير ويعطي نتائج سلبية. ويمكن إضافة كربونات الكالسيوم للحفاظ على الرقم الهيدروجيني.
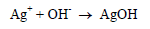
ثانياً/ طريقة فولهارد Volhard’s method
– يستخدم في هذه الطريقة دليل الحديد الثلاثي Fe3+ للكشف عن نقطة النهاية والذي يتفاعل مع ايونات الثيوسيانات Thiocyanate ion, SCN– (المضاف من السحاحة) وعند نهاية يتكون راسب أحمر قاتم مع أول قطرة زائدة من أيون الثيوسيانات.
– تجرى معايرات فولهارد في وسط حامضي لمنع ترسب الحديد على شكل هيدروكسيد.
(1) الطريقة المباشرة Direct method
– في هذه الطريقة يستخدم ايون الثيوسيانات القياسي لتقدير الفضة.– الشكل التالي يوضح طريقة فولهارد المباشرة لتقدير الفضة بواسطة محلول قياسي من الثيوسيانات.
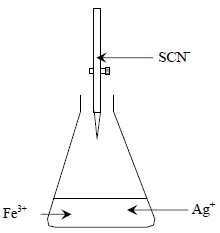
(أ) قبل نقطة التكافؤ Before end-point
قبل نقطة التكافؤ فإن أي إضافة من ايون الثيوسيانات (في السحاحة) يتفاعل مع ايونات الفضة Ag+ ويتكون راسب أبيض من ثيوسيانات الفضة.

(ب) عند نقطة التكافؤ At end-point
عند نقطة التكافؤ أي بعد ترسيب كل أيونات Ag+ في المحلول فإن أول قطرة زائدة من أيون الثيوسيانات سوف تتفاعل مع أيونات Fe+3 (الدليل) حسب التفاعل التالي:
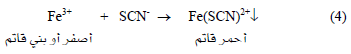
علماً بأن المعادلة رقم (3) تمثل تفاعل المعايرة ، والمعادلة رقم (4) تمثل تفاعل الدليل
(2) الطريقة الغير مباشرة Indirect method
– تستخدم هذه الطريقة لتقدير الهاليدات Halides مثل الكلوريد Chloride, Cl– والبروميد Bromide, Br– وكذلك الثيوسيانات –.Thiocyanate, SCN
– في هذه الطريقة تضاف كمية معلومة من نترات الفضة القياسي لمحلول العينة المراد تحليلها (Cl–) مثلاً. ويكون حجم نترات الفضة المضاف أكبر مما نحتاجه لترسيب المادة المراد تقديرها (أي كمية زائدة).
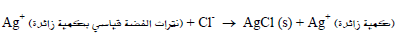
وهذا التفاعل يمثل التفاعل الأول في المعايرة
– الكمية الزائدة من التفاعل أعلاه تعاير بمعايرة خلفية Back titration من أيون الثيوسيانات القياسي.
–تفاعل المعايرة الخلفية:
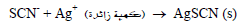
– عند نقطة التكافؤ فإن أول قطرة زائدة من أيون الثيوسيانات سوف تتفاعل مع ايون الحديد الثلاثي (الدليل) حسب التفاعل التالي:
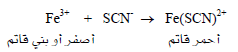
– ملاحظة : يجب ترشيح وإبعاد راسب كلوريد الفضة من تفاعل المعايرة الاولى قبل إجراء المعايرة الخلفية. ويمكن معرفة حسابات المعايرة الخلفية من المثال التالي:
مثال: تم تحليل عينة لتقدير الكلوريد بطريقة فولهارد حيث أضيف 40 مل من نترات الفضة (كمية زائدة) بتركيز 0.1234 مولار إلى محلول العينة ثم تمت معايرة نترات الفضة الفائضة باستخدام الثيوسيانات (معايرة خلفية) وكان حجم الثيوسيانات عند نقطة التكافؤ 12.2 مل علماً بأن مولاريةMolarity الثيوسيانات تساوي 0.0930 احسب عدد مللمولات Millimoles الكلوريد في العينة ثم احسب النسبة المئوية إذا كان وزن العينة 300 ملجم.
الحل:
يجب أولاً وضع قانون عام لهذا النوع من المعايرات الخلفية بالخطوات التالية:

يحسب عدد مللمولات المادة A الذي تم تفاعلها مع المادة B يمكن حسابة كالآتي:
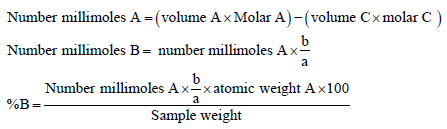
في المثال أعلاه: A= نترات الفضة ، B= الكلوريد ، C= الثيوسيانات
يحسب عدد مللمولات نترات الفضة المتفاعل مع الكلوريد كالتالي:
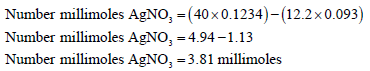
عدد مللمولات الكلوريد:
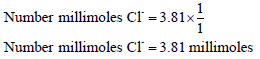
النسبة المئوية للكلوريد:
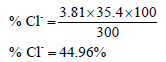
ثالثاً/ طريقة فاجان Fajan’s method
– الدليل المستخدم هنا (دليل الفلورسين) Fluorescein indicator من الأدلة التي تمتز على سطح الراسب عند نقطة التكافؤ ولا يحدث له تفاعل مع المحلول المعاير كما في حالة ادلة طريقة موهر و فولهارد.
– الشكل التالي يوضح طريقة فاجان لتقدير الكلوريد بواسطة محلول قياسي من نترات الفضة
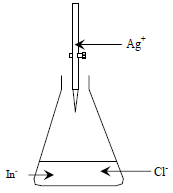
– يضاف محلول نترات الفضة القياسي من السحاحة على محلول الكلوريد مثلاً في دورق المعايرة الذي يحتوي أيضاً على أنيون الدليل In–
قبل نقطة التكافؤ Before end-point
– قبل نقطة التكافؤ يوجد الكلوريد بكثرة في دورق المعايرة لذا تكون Cl– هي الطبقة الأولية الممتزة Adsorbed على سطح راسب كلوريد لفضة والتي تتنافر مع آنيون الدليل ، وعليه تكون الطبقة الثانوية الممتزة هي أيونات موجبة كالصوديوم.
– الشكل التالي يوضح ترتيب الطبقات قبل نقطة التكافؤ.
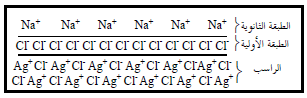
بعد نقطة التكافؤ After end-point
– بعد نقطة التكافؤ مباشرة وعند تفاعل كل من الكلوريد وترسيبه على شكل AgCl فإن أول قطرة زائدة مضافة من Ag+ من السحاحة تكون في حالة زائدة ويصبح سطح الراسب مشحوناً بشحنة موجبة، لذا تكون أيونات الدليل In– هي الطبقة الثانوية الممتزة.
– الشكل التالي يوضح امتراز الدليل على سطح الراسب بعد نقطة التكافؤ:

– وبما أن لون الدليل الممتز يختلف عن لون الدليل غير الممتز ، نجد أن الفرق بين اللونين يمثل نقطة التكافؤ.
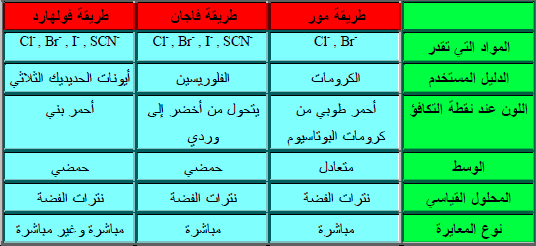
مقارنة مختصرة بين طرق القياس الفضي
المراجع:
– كتاب اساسيات الكيمياء التحليلية (تخصص مختبرات كيميائية 165 كيم) / المؤسسة العامة للتدريب التقنى والمهنى / السعودية / طبعة 1429م .
– محاضرات الكيمياء التحليلية (التحليل الحجمى والوزني) / خيرية محمد عبدالله الأحمري /(1430 – 1429 هـ ) / جامعة الملك عبد العزيز- المملكة العربية السعودية.






