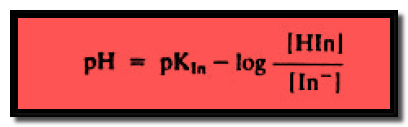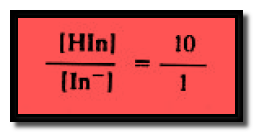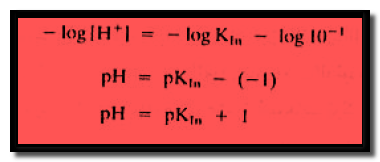المدى الهيدروجيني للدليل المستخدم فى تفاعلات المعايرة
محتويات الموضوع
تعريف المدى الهيدروجيني للدليل pH Indicators range
– يعرف المدى الهيدروجيني للدليل بأنه المجال من الرقم الهيدروجيني الذي يتغير فيه لون الدليل.
استنتاج قيم المدى الهيدروجينى لأدلة المعايرة
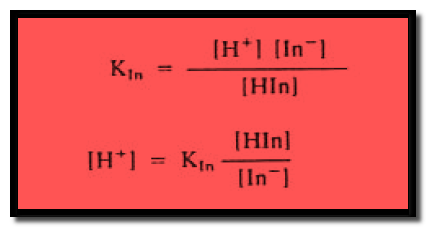
– فإذا كان لدينا دليل ماHIn فإنه يتأين تبعاً المعادلة الآتية كما يلي:
ويمكن التعبير عن ثابن الأتزان KIn لتأين الدليل كما يلي:
وبأخذ اللوغاريتم السالب لطرفي المعادلة تصبح المعادلة كما يلي:
أى أن:
– يتبين من المعادلة السابقة أن النسبة بين تركيزي الشكل المتأين والشكل غير المتأين للدليل تتغير باستمرار بتغير تركيز أيون الهيدروجين وبذلك يتغير لون الدليل باستمرار مع تغير تركيز أيون الهيدروجين أو تغير الرقم الهيدروجيني للمحلول.
– يظهر التغير في لون المحلول واضحاً بالعين المجردة فقط في مجال تتغير فيه نسبة تركيز الشكل الحامضي إلى الشكل القاعدي من عشرة أضعاف إلى 1/10 ضعف (أي تصبح نسبة تركيز الشكل القاعدي عشرة أضعاف تركيز الشكل الحامضي أو العكس).
– وعلى ذلك فأن التغير اللوني يترافق مع تحول رئيسي في وضع اتزان الدليل.
– ويمكن القول بأن الدليل هو لون شكله الحامضي عندما يكون تركيز شكله الحامضي عشرة أضعاف تركيز شكله القاعدي أي:
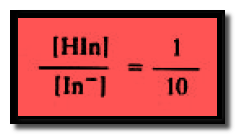
– ولونه هو لون شكله القاعدي عندما يكون تركيز شكله القاعدي عشرة أضعاف تركيز شكله الحامضي أى أن:
– بين هاتين النسبتين يكون لون الدليل هو اللون الناتج عند مزج الشكلين بنسب مختلفة.
– وبالطبع تمثل هذة الأرقام السلوك العام للأدلة حيث أن هناك أدلة تتطلب نسبة تغير للشكلين الحامضي والقاعدي أكبر مما سبق لظهور التغير اللوني كما أن هناك أدلة أخري تتطلب نسبة تغير أقل.
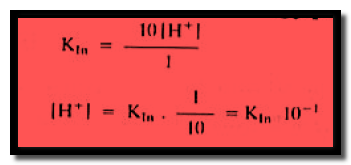
– يمكننا الآن التعويض بهذه القيم في معادلة ثابت التأين للدليل فيظهر الدليل بلون الشكل الحامضي عندما يكون:
– وبأخذ اللوغاريتم السالب لطرفي المعادلة تصبح المعادلة كما يلي:
للون الحامضي
– ويظهر لون الشكل القاعدي للدليل عندما يكون:
– وبأخذ اللوغاريتم السالب لطرفي المعادلة تصبح المعادلة كما يلي:
للون القاعدي
– ومما سبق يتبين أن التغير في الرقم الهيدروجيني عند طرفي المجال الذي يحدث فية التغير في لون الدليل يساوي وحدتين من الرقم الهيدروجيني.
أي تصبح المعادلة كما يلي:
مثال للتوضيح
– فمثلاً ثابت تأين دليل الفينول فثالين يساوي 10-9 وبهذا يكون مدي الرقم الهيدروجيني لتغير لونه من 8 إلى 10 .
– فعندما يكون الرقم الهيدروجيني أقل من 8 فيظهر لون الشكل الحامضي للدليل وهو عديم اللون.
– أما عندما يكون الرقم الهيدروجيني أكبر من 10 فيظهر لون الشكل القاعدي للدليل أي اللون الأحمر.
– أما في المجال من 8 -10 فيكون اللون وسطاً أي وردياً باهتاً.
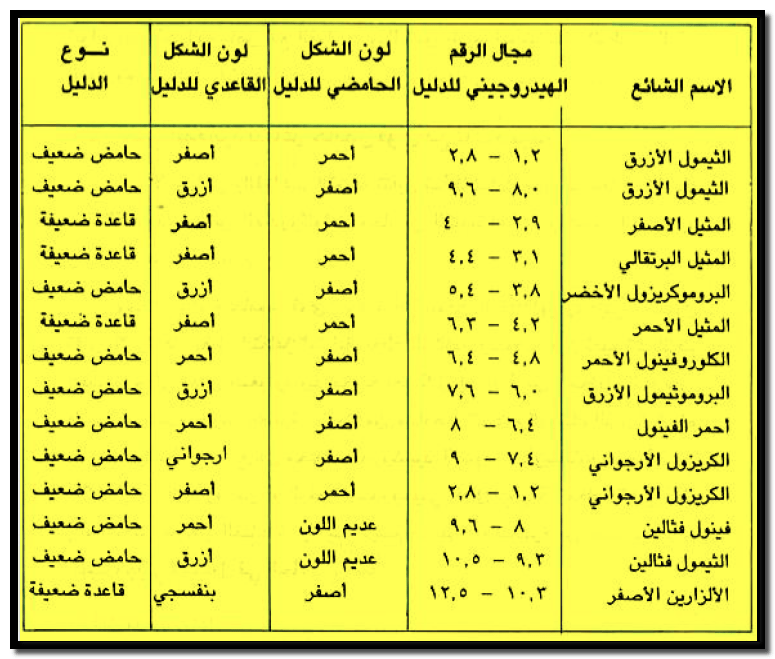
قيم المدى الهيدروجيني لأدلة التعادل المعروفة
– هذا ويوجد العديد من الأدلة التي لها ثوابت تأين متفاوتة تغطي مدي واسعاً من الرقم الهيدروجيني.
– الجدول التالي يبين بعض أدلة التعادل ومدى الرقم الهيدروجيني لكل منها وألون أشكالها الحامضية والقاعدية كما يلي:
كيف تختار الدليل المناسب فى معايرات التعادل؟
– لإختيار الدليل المناسب في تفاعلات التعادل فإنه من الضروري تحديد الرقم الهيدروجيني للمحلول عند نقطة التكافؤ.
– ولمعرفة ذلك يلزم رسم منحنى المعايرة لتفاعل حمض مع قاعدة ويتم ذلك عملياً بقياس الرقم الهيدروجيني للمحلول بعد إضافة حجوم متتالية ومعلومة من القاعدة أو الحمض أثناء المعايرة.
المراجع : المدى الهيدروجينى للدليل pH Indicators range – الفصل الثاني (أسس التحليل بالمعايرة) من كتاب التحليل الكيميائي الكمي التقليدي لطلاب الكليات والجامعات من تأليف : أ.د/محمد أحمد آشي ، أ.د/ عبد الغني حمزة ، د/ توفيق عميرة ، د/ عبد العزيز السباعي ، د/ أحمد عشي .