حاصل الإذابة Solubility Product
– في هذا الموضوع سنتعرف على الإذابة وحاصل الإذابة Solubility and solubility product بالتفصيل كما أنه يمكنك متابعة هذا الموضوع أيضاَ: مسائل محلولة على حاصل الإذابة (Solubility product (Ksp
محتويات الموضوع
ما هي الإذابة Solubility؟
– تعتبر الإذابة من الأمور المهمة فى التحليل الوزني حيث أنها مقياس للطبيعة الكمية لعملية الترسيب.
– يمكن أن تعني الزيادة فى الإذابة بين كون الطريقة تصنف كمية أو غير كمية.
– تعرف الإذابة بأنها كمية المذاب القابلة للذوبان فى حجم معين من المذيب بدرجة حرارة معينة علماً أن جميع المواد لها إذابة معينة.
– تعتمد الإذابة بشكل عام على نوع المذيب ونوع المذاب.
ذوبان الأملاح الأيونية Solubility of ionic salts
– تظهر المركبات الأيونية بشكل عام أكبر إذابة في المذيبات القطبية مثل الماء.
– تحدث عملية الإذابة لأن جزئيات المذيب القطبي تنجذب بدرجة كافية إلى الأيونات وتسحبها بعيداً عن مواضعها في شبكة البلورة.
– إثناء هذه العملية تصبح الأيونات متذاوبة solavated، وبالرغم من أن الأيون الموجب والأيون السالب ممثلان بشكل أيونات ذائبة إلا أن التجاذب بين جزئي الماء وأيون المعدن ضعيف.
– ولما كانت جزئيات الماء والأيونات فى المحلول في حركة سريعة مستمرة فإن عدد جزئيات الماء حول أيون المعدن يميل إلى التغيير ويشار إلى العدد المتوسط بعدد التميؤ Hydration number وفى البلورات يكون عدد جزئيات الماء ثابتاً.
ذوبان المركبات التساهمية Solubility of covalent compounds
– يعتمد ذوبان المركبات التساهمية على طبيعة التركيب الجزيئي للمركبات.
– فبعض المركبات أيونية الصفة بينما يكون البعض الآخر تساهمي الصفة تماماً.
– يمكن تقسيم القوى التي تمسك الجزئيات بعضها ببعض كما يلي:
- قوي لندن (قوي التجاذب القطبية المستحثة induced dipole attractions)
- قوي التجاذب ثنائية القطب dipole-dipole forces
- قوي التجاذب بين الأيونات والجزئيات ثنائية القطب Ion dipole forces
- الرابطة الهيدروجينية.
– أن لمن المهم جداً النظر إلى إذابة العامل المرسب فى التحليل الوزني وخصوصاً عند استعمال عوامل مرسبة عضوية.
– إذا كان العامل المرسب محدود الإذابة فإن الراسب تصحبه شوائب عند زيادة العامل المرسب.
– تحتوى العديد من العوامل المرسبة العضوية على مجموعات وظيفية قاعدية أو حامضية بحيث تزداد إذابة هذه المركبات فى الماء وفي مذيبات قطبية أخري.
– غالباً ما تزداد إذابة عامل مرسب مفيد تحليلاً بإدخال مجموعة حامض السلفونيك Sulphonic acid group في الجزئ.
– وهكذا وبإدراك العوامل التي تؤثر على الإذابة يمكن اختيار مذيب أو خليط مذيب مناسب أو يمكن تطوير العامل المرسب تركيبياً لزيادة الإذابة.
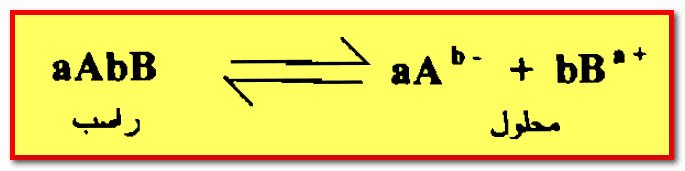
حاصل الإذابة Solubility Product
– عند مزج محلول كلوريد الصوديوم مع محلول نترات الفضة ( تركيز كل منهما على سبيل المثال 0.1M ) يظهر راسب كلوريد الفضة مباشرة ويكون هذا الراسب في حالة اتزان مع أيونات الكلوريد والفضة في المحلول.
– يسمى هذا المحلول بأنه مشبع براسب كلوريد الفضة لهذا فإن:
– من الحقائق التجريبية أنه في مثل هذا المحلول المشبع يكون حاصل ضرب تركيز أيونات الكلوريد ثابتاً عند ثبوت درجة الحرارة.
– يطلق على هذه القيمة الثابتة بأنها حاصل الإذابة لكلوريد الفضة Ksp
تعريف حاصل الإذابة
– لهذا فإن حاصل الإذابة لملح شحيح يعرف بأنه حاصل ضرب التركيز المولاري للأيونات الموجودة فى المحلول مرفوعاً لأس عدد الأيونات المتضمنة فى معادلة الاتزان الكيميائي للمحلول المشبع.
– يتضح من معادلة حاصل الإذابة بإن تركيز الأيونات في المحلول يمكن أن يتغير لكن حاصل ضرب تركيز هذة الأيونات يجب أن يبقي ثابتاً ما دام راسب الملح موجوداً وأن درجة الحرارة ثابتة.
المراجع : الإذابة وحاصل الإذابة Solubility and solubility product – الباب الثالث / الإذابة وحاصل الإذابة Solubility and solubility product. من كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي ) للمؤلف / محمد مجدي عبدالله واصل.










كيف يمكنني صنع مانع تجمد لوقود السيارات التي تعمل على الديزل حيث نسبة الشحوم المحلوله في الديزل عاليه لهذا هي تتجمد عند انخفاض درجة الحراره تحت العشر درجات مئويه