قياس حرارة التفاعل + مسائل محلولة
محتويات الموضوع
قياس حرارة التفاعل
– سيتم مناقشة قياس حرارة التفاعل بطريقتين هما كما يلي:
(1) قياس حرارة التفاعل (حرارة الاحتراق) عند ضغط ثابت.
(2) قياس حرارة التفاعل (غير الاحتراق) عند ضغط ثابت.
أولاً/ قياس حرارة الاحتراق عند ضغط ثابت
– التغیرات الحراریة نتیجة لاحتراق أي مادة تقاس عند حجم ثابت، وذلك باستخدام ما یسمى المسعر Calorimeter (مسعر القنبلة Bomb Calorimeter).
– فالمسعر الحراري جھاز یستخدم لقیاس التغیرات الحراریة (كمیة الحرارة الممتصة أو المنبعثة) المصاحبة للتفاعلات الكیمیائیة.
– ویتحدد نوع المسعر الحراري المطلوب استخدامه تبعاً لنوع التفاعل الكيميائي المدروس بمعنى إذا كان التفاعل یتم عند ضغط ثابت أم یتم عند حجم ثابت.
– ومسعر القنبلة یستخدم لقیاس الحرارة المنطلقة في أثناء عملیات الإحتراق.
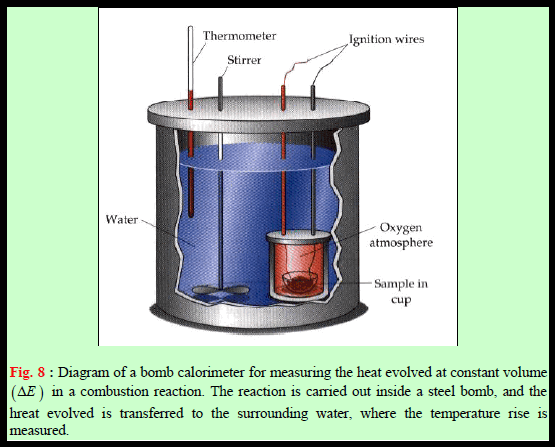
وصف جهاز المسعر
– یتكون المسعر الحراري عادة – كما ھو موضح بالشكل التالي:
(1) إناء خارجي معزول عزلاً حراریاً جیداً حتى یمنع تسرب الحرارة من داخل أو خارج ھذا الإناء.
– وتوضع في ھذا الإناء الخارجي كمیة معینة من الماء معلومة الوزن بدقة، حیث یغمر به الوعاء الذي سیتم به التفاعل.
(2) مقیاس لدرجة الحرارة.
(3) مصدر للإشعال.
(4) محرك.
كیف تقاس الحرارة المنطلقة نتيجة لاحتراق مادة ما في المسعر؟
(1) توزن كمیة معینة بدقة من المادة المتفاعلة (المراد قیاس حرارة احتراقها) وتوضع في وعاء التفاعل.
(2) ثم یملأ وعاء التفاعل بغاز الأكسجین تحت ضغط عال.
(3) یوضع وعاء التفاعل في الوعاء المعزول.
(4) ثم یغمر وعاء التفاعل (المسعر) بكمیة معینة من الماء موزونة بدقة والذي یوضع في وعاء معزول عزلاً تاماً.
(5) ثم یحرك الماء بمقلب (محرك) (Stirrer) من أجل أن تكون درجة حرارة الماء متجانسة مع بقیة أجزاء المسعر.
(6) تسجل درجة حرارة المجموعة الابتدائية (درجة حرارة العینة) ولتكن (t1).
(7) یبدأ التفاعل (عملیة الإحتراق) بواسطة مصدر الإشعال أو بالتسخین الكھربي للمادة (سلك كھربي مغموس في المادة).
(8) تمتص الحرارة المنطلقة نتیجة للتفاعل من قبل المسعر ومكوناته وترتفع درجة حرارة المجموعة ثم تسجل درجة الحرارة النھائیة (t2).
(9) حیث أن كلاً من الماء والمسعر یمتص الحرارة فإن السعة الحراریة الكلیة (Ct) تساوي مجموع السعة الحراریة للمسعر والماء أي أن:
Ctotal = CH2O + CCal
حيث أن:
CH2O: السعة الحراریة للماء وتحسب من كتلة الماء المستخدم وحرارة الماء النوعیة.
Ccal: السعة الحراریة للمسعر، وتقدر عملیاً وذلك بقیاس الزیادة في درجة حرارة المسعر نتیجة تسخینه بكمیة معروفة من الحرارة.
(10) كمية الحرارة المنطلقة في التجربة (q) تحسب من السعة الحرارية الكلية (Ct) ومن الزيادة في درجة الحرارة (t1-t2) باستخدام المعادلة كما يلي:
q = Ct Δt
Ct: السعة الحراریة الكلیة.
Δt = t2 –t1 الفرق في درجة الحرارة
ملاحظات هامة على قياس حرارة التفاعل (حرارة الإحتراق)
– كمیة الحرارة المصاحبة للتفاعل الكیمیائي التي وضحنا كیفیة تعیینھا وحسابھا فیما سبق تنتج عن تفاعل یتم في إناء مغلق، یبقى الحجم ثابتاً طوال فترة التفاعل، حیث لا یكون ھناك مجال لعمل أي شغل (work = 0) ویرمز لكمیة للتغیر الحراري، المصاحب للتفاعلات التي تتم عند حجم ثابت بالرمز (qv)
– ویمكن أن ینتج ھذا التغیر الحراري عن تفاعل یتم في آنیة مفتوحة، معرضة للضغط الجوي، بمعنى أن یبقى الضغط ثابتاً طوال فترة التفاعل، ویرمز للتغیر الحراري في ھذه الحالة بالرمز (qp)
– والحرارة المنطلقة من تفاعلات كیمیائیة تجري تحت ضغط ثابت، یمكن إرجاعھا الى التغیر فیما یسمى بالمحتوى الحراري أو الإنثالبي (Enthalpy). ولقد أشرنا إلیه في جزء سابق وبینا أن لكل مادة نقیة انثالبي محدد عند ثبوت الضغط ودرجة الحرارة، وأنه في أي تفاعل كیمیائي یمكن التعبیر عن التغیر في المحتوى الحراري (ΔH) من خلال الفرق بین المحتوى الحراري للمواد المتفاعلة والمحتوى الحراري للنواتج.
– في حالة التفاعلات التي تنطلق منھا حرارة، یكون المحتوى الحراري (الإنثالبي) للنواتج أقل من المحتوي للحراري للمتفاعلات وبالتالي فإن المحتوى الحراري ذا قیمة سالبة: ΔH = –
– أما في حالة التفاعلات التي تمتص حرارة، یكون المحتوى الحراري للنواتج أكبر من المحتوى الحراري للمتفاعلات، وعندھا فإن المحتوى الحراري ذا قیمة موجبة: ΔH = +
مسائل محلولة على قياس حرارة التفاعل
مثال (1)
أجري تفاعل كیمیائي في مسعر حراري، یحتوي على 1.2 Kg من الماء، فارتفعت درجة الحرارة من 20 Co إلى 25 Co احسب كمیة الحرارة الناتجة عن التفاعل. علماً بأن السعة الحرارية للمسعر ھي 2.21 kJ/Co والحرارة النوعية للماء ھي 4.184 J/g.Co
الحل:
یمكن حل ھذه المسألة بالعلاقة التالیة كما يلي:
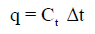
وبما أن التفاعل طارد للحرارة فإننا نضع الإشارة سالب:
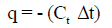
للدلالة أن التفاعل طارد للحرارة.
وبالتعویض في ھذه العلاقة الأتية كما يلي :
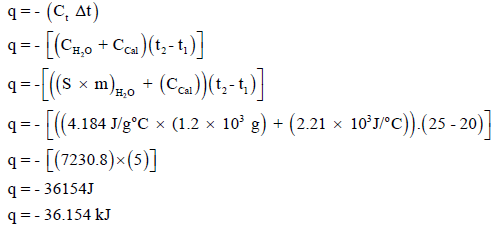
ویمكن حل ھذه المسألة بطریقة أخرى، وھي أن حرارة التفاعل (q) تساوي كمیة الحرارة التي امتصھا المسعر زائداً كمیة الحرارة التي امتصھا الماء أي أن:
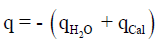
وبالتالي نعوض فیھا كما یلي:
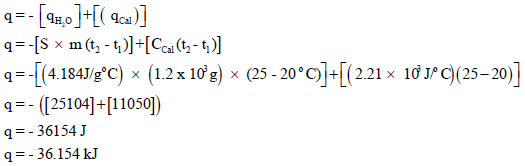
مثال (2)
یستخدم مسعر القنبلة لقیاس الحرارة المنطلقة من احتراق الجلوكوز (C6H12O6) فإذا وضعت (3g) من الجلوكوز في المسعر المملوء بالأكسجين تحت ضغط، والذي یحتوي (1.5 kg) من الماء، وكانت درجة الحرارة الابتدائیة ھي (19 Co)احترق الخلیط المتفاعل بالتسخین الكھربي بالسلك. وسبب التفاعل زیادة في درجة حرارة المسعر ومحتویاته الى (25.5 Co) فإذا علمت أن السعة الحراریة للمسعر ھي 2.21 kJ/Co احسب كمیة الحرارة المنطلقة عند حرق مول واحد من الجلوكوز (علماً بأن الحرارة النوعیة للماء ھي 4.184 J/g.Co)؟
الحل:
باتباع نفس الخطوات في المسألة السابقة فإن كمیة الحرارة الناتجة من حرق (3g) من الجلوكوز تكون كما يلي:

وبالتالي فإن كمیة الحرارة المنطلقة من مول واحد والذي یعادل:
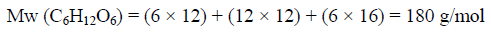
یمكن حسابه على النحو التالي كما يلي:
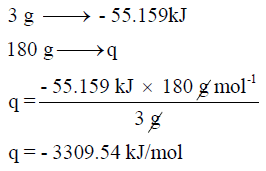
مثال (3)
إذا احترق (1.435 g) من مركب النفثالين (C10H8) في مسعر حراري عند حجم ثابت یحتوي على 2000 g من الماء، فأن درجة الحرارة ترتفع من 20.17 Co إلى 25.84 Co علماً بأن السعة الحرارية للمسعر ھي 1.80 kJ/Co والحرارة النوعية للماء ھي 4.184 J/g.Co والكتل الذرية ( (C = 12 , H =1 فاحسب:
(أ) الحرارة المنطلقة نتیجة الاحتراق.
(ب) الحرارة المنطلقة نتیجة احتراق مول واحد من النفثالین.
الحل:
(أ) لحساب كمیة الحرارة المنطلقة من احتراق (1.435 g) من مركب النفثالين نتبع العلاقة كما يلي:
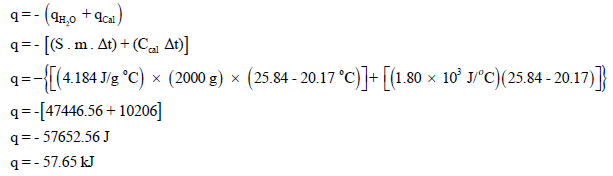
(ب) ولحساب كمیة الحرارة المنطلقة من احتراق مول واحد من النفثالین كان لزاماً تحویل كمیة النفثالین السابقة (1.435 g) إلى مولات باستخدام العلاقة الأتية كما يلي:
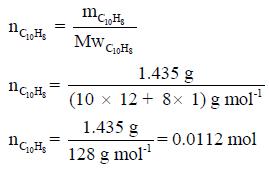
وھذه الكمیة من المولات (0.0112 mol) عند احتراقھا ینتج عنھا (57.65 KJ) وبالتالي فإن كمیة الحرارة المنطلقة نتیجة مول واحد من النفثالین یمكن حسابھا بإجراء التناسب الآتي كما يلي:
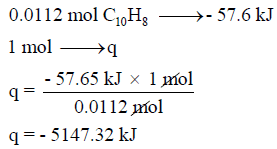
ویمكن حساب كمیة الحرارة الناتجة بالتعبیر عن كمیة مول من النفثالین بالجرامات حیث كتلة مول واحد من النفثالین تساوي 128 g إذاً:
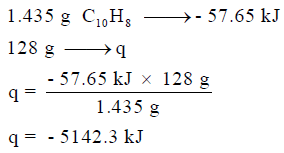
مثال (4)
إذا علمت أن حرارة احتراف النفثالين (C10H8) هي 1232 kcal/mol ، فاحسب الارتفاع في درجة حرارة 1.025 kg ماء موضوعة في مسعر إذا أحرقنا 0.242 g من النفثالین، بفرض أن الحرارة الناتجة استخدمت لرفع درجة حرارة الماء
فقط. علماً بأن الحرارة النوعية للماء ھي 1 cal/g.Co والكتل الذرية (C = 12 , H =1 , O = 16)
الحل:
نحسب أولاً كمیة الحرارة الناتجة من احتراق 0.242 g من النفثالین بعد تحویلھا الى مولات كما يلي:
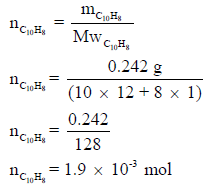
وبالتالي فإن:
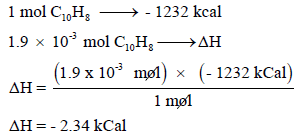
وكمیة الحرارة ھذه امتصت من قبل الماء أي:
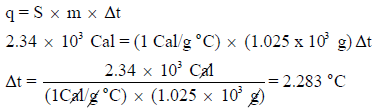
ثانياً/ قياس حرارة التفاعل (غير الاحتراق) عند ضغط ثابت
نعم یمكن قیاس حرارة تفاعل كیمیائي غیر الإحتراق (مثل تفاعلات الأحماض والقواعد) باستخدام مسعر عند ضغط ثابت كما في الشكل التالي:
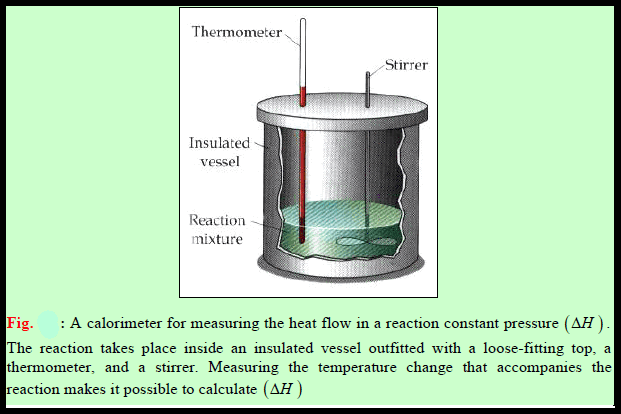
وبما أن القیاسات تجرى عند ضغط ثابت (الضغط الجوي) فإن التغیر في الحرارة (q) یساوي التغیر في الإنثالبي:
qp = ΔH
والجدول التالي یبین قیم التغیر في الإنثالبي لبعض التغیرات الكیمیائیة والفیزیائیة عند ضغط ثابت.

مثال (5)
أذا وضع (100 ml) من حمض الهيدروكلوريك (HCl) تركيزه (0.5 M) مع (100 ml) من هيدروكسيد الصوديوم (NaOH) تركيزه (0.5M) في مسعر عند ضغط ثابت سعته الحرارية (3335 J/Co) وكانت درجة حرارة المزيج الأبتدائية تساوي 22.5 Co والنهائية 24.9 Co ، فاحسب التغیر في إنثالبي التفاعل على افتراض أن الكثافة والحرارة النوعیة للمحلول تساوي الكثافة والحرارة النوعیة للماء.
الحل:
كثافة المحلول = كثافة الماء = 1 g/ml
الحرارة النوعية للمحلول = الحرارة النوعية للماء = 4.184 J/g Co
ولحساب كتلة المحلول (msol) من الكثافة نتبع العلاقة:
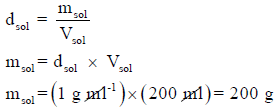
ولحساب كمیة الحرارة الناتجة من التعادل نتبع العلاقة :
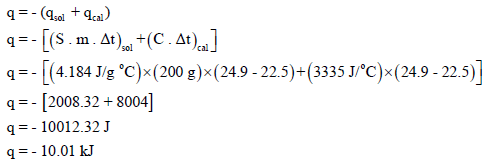
المراجع – أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية