نظرية الكم Quantum theory – أسباب ظهور نظرية الكم
– كانت أخفاقات نظريات الفيزياء الكلاسيكية فى تفسير المسائل المتعلقة بالظواهر الذرية والجزيئية هي أهم أسباب ظهور نظرية الكم Quantum theory
محتويات الموضوع
إخفاقات الفيزياء الكلاسيكية أهم أسباب ظهور نظرية الكم
– كان الاعتقاد السائد عند بعض الفيزيائيين فى القرن التاسع عشر بأن التركيب النظري للفيزياء الكلاسيكية هي العلم الذي نما قبل 1900 ويتضمن ميكانيكا نيوتن الكلاسيكية ونظرية ماكسويل فى الكهربائية والمغناطيسية والأشعة الكهرومغناطيسية والديناميكا الحرارية ونظرية الحركية للغازات.
– ثم بعد ذلك أصبح العلم متكاملاً وبمقدوره إعطاء التفسير عن الظواهر الملحوظة ولكن فى الربع الأخير من هذا القرن، ظهرت نتائج عملية لم تتمكن نظريات الفيزياء الكلاسيكية من تفسيرها.
– وهذه النتائج العملية كانت تتعلق بظواهر ذرية وجزيئية وقد حدا هذا الأمر آنذاك الباحثين إلى صياغة نظرية جديدة بإمكانها إعطاء تفسير مقبول منسجم مع النتائج العملية. هذه النظرية تسمي نظرية الكم Quantum theory.
– أخفقت الفيزياء الكلاسيكية فى تفسير المسائل المتعلقة بالظواهر الذرية والجزيئية وهي تتضمن كما يلي:
(1) اشعاع الجسم الأسود.
(2) التأثير الكهروضوئي.
(3) الخطوط الطيفية الذرية.
(1) تفسير إشعاع الجسم الأسود
– أن أخفاق الفيزياء الكلاسيكية فى تفسير ظاهرة إشعاع الجسم الأسود واحد من أهم أسباب ظهور نظرية الكم.
– إن الجسم الأسود هو الجسم أو المادة التى تمتص جميع الأشعة الكهرومغناطيسية الساقطة علية.
– وأحسن نموذج تقريبي للجسم الأسود هو مجوف كروي ذو ثقب صغير جداً يسمح بدخول الأشعة.
– إن أية أشعة تدخل هذا الثقب سيتم حجزها فى داخل المجوف وبالتالي امتصاصها.
– والشكل التالي يوضح التوزيع الطاقي فى الجسم الأسود عند درجة حرارة إن أية أشعة تدخل هذا الثقب سيتم حجزها فى داخل المجوف وبالتالي امتصاصها.
– والشكل التالي يوضح التوزيع الطاقي فى الجسم الأسود عند درجة حرارة 1500K كما يلي:
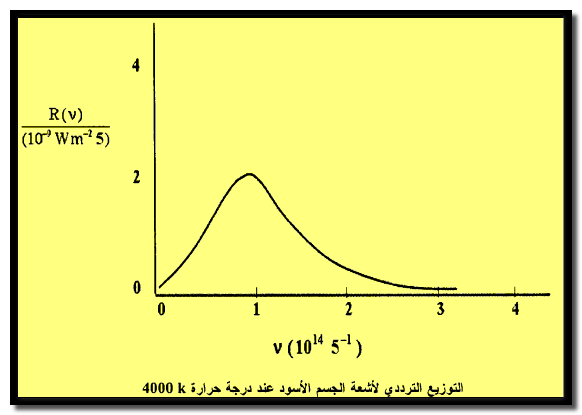
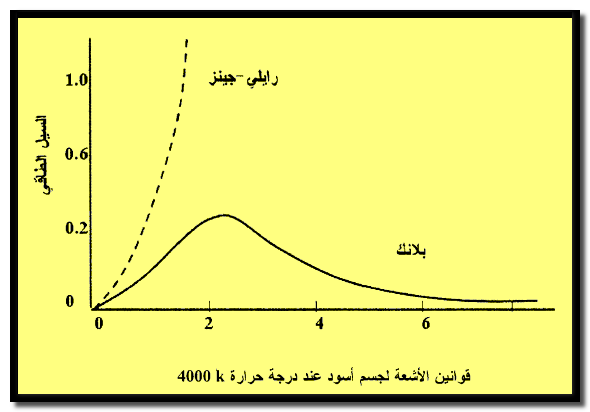
– أن المحاولات النظرية لاستنباط هذا السلوك ثانية كانت من قبل ألفين عام 1896 ورايلي عام 1900 ولم يحالفهما النجاح.
– حيث تمكن قين من اشتقاق معادلة ملائمة للنتائج عند الأطوال الموجبة القصيرة فى حين تمكن رايلي من الحصول على معادلة مناسبة عند الأطوال الموجية الكبيرة.
معادلة بلانك لتفسير اشعاع الجسم الأسود
– إن عدم وجود علاقة رياضية تلائم جميع الأطوال دفعت ماكس بلانك وذلك عام 1900 إلى اقتراح فرضية جديدة مفادها أن ذرات أو جزئيات الجسم الأسود يمكنها بعث أو امتصاص طاقة كهرومغناطيسية ذات تردد υ بمقادير معينة أو كميات والمقدار هنا هو υλ سمي بثابت بلانك فقط.
– فى حين وفقاً للفيزياء الكلاسيكية يفقد أو يكتسب النظام أية مقدار من الطاقة دون تحديد.
– وإذا رمزنا ΔE لتغير الطاقي فى ذرة الجسم الأسود نتيجة لانبعاث أشعة كهرومغناطيسية ذات التردد υ عندئذ يكون ΔE= υλ. وتسمى ΔE أيضا بطاقة الكم energy of quantum أما ثابت بلانك h فيساوي 6.626x10-34 جول.ثانية
– وباستخدام هذه الفرضية – فرضية بلانك – استطاع وضع تعبير رياضي للتوزيع الطاقي فى الجسم الأسود كما يلي:
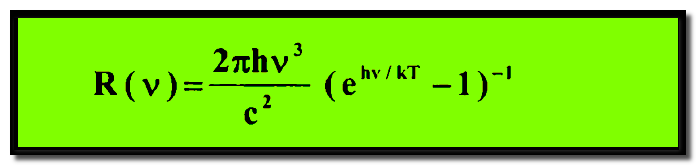
(R(υ هي دالة تمثل التوزيع الترددي لأشعة الجسم الأسود المنبعثة.
K = ثابت بولتزمان
C = هي سرعة الضوء.
– هذه العلاقة تسمى بقانون بلانك وهي تعطي نتيجة منسجمة بصورة جيدة مع التوزيع الطيفي الملحوظ لأشعة الجسم الأسود.
– والشكل التالي يبين ملائمة محاولة بلانك النظرية مع النتيجة العملية المبينة فى الشكل السابق بعكس محاولة رايلي كما يلي:
(2) تفسير ظاهرة التأثير الكهروضوئي
– إن أول شخص أدرك قيمة فكرة بلانك هو ألبرت أينشتاين الذي استخدام مفهوم التكمم الطاقي energy of quantization لأشعة الكهرومغناطيسية لتفسير النتائج العملية فى ظاهرة التأثير الكهروضوئي.
– كما أن التأثير الكهروضوئي يحدث عند تسلط أشعة كهرومغناطيسية – أي ضوء – على سطح مؤدية إلى انبعاث إلكترونات من المعدن فالإلكترونات تمتص طاقة من الضوء وبذلك تكتسب طاقة كافية لمغادرة المعدن.
– وقد بينت نتائج لينارد Lenard العملية كما يلي:
(1) الإلكترونات تنبعث عندما يكون تردد الضوء الساقط يتجاوز حداً أدني من التردد 0υ بتردد العتبة Threshold frequency. وأن قيمة 0υ تختلف من معدن لآخر وهي تقع ضمن المنطقة فوق البنفسجية لمعظم المعادن.
(2) زيادة شدة الضوء الساقط سيزيد من عدد الإلكترونات المنبعثة ولكنها لا تؤثر فى الطاقة الحركية للإلكترونات المنبعثة.
(3) زيادة تردد الضوء الساقط سيزيد الطاقة الحركية للإلكترونات المنبعثة.
– كما أن ملاحظات لينارد على التأثير الكهروضوئي لا يمكن فهمهما باستخدام الصورة الكلاسيكية للضوء التى تعتبره على أساس أنه موجة wave.
– ووجد أن الطاقة فى موجة تتناسب مع شدتها Intensity ولا تعتمد على ترددها وبذلك نتوقع ازدياد الطاقة الحركية للإلكترونات المنبعثة كلما زادت شدة الضوء ولا تعتمد على تردد الضوء.
– علاوة على ذلك فالصورة الموجية للضوء تتوقع حدوث التأثير الكهروضوئي عند أى تردد بشرط أن يكون الضوء الساقط بدرجة كافية من الشدة.
تفسير أينشتاين لظاهرة التأثير الكهروضوئي
– قد اقترح أينشتاين إلى جانب كون الضوء يمتلك خواصاً موجية فانه أيضا يمكن أن يؤخذ على أساس أنه متكون من كيانات جسيمية أى كمات quanta.
– كما أن كل كم من الضوء له طاقة υλ ، هذه الكيانات تدعي فوتونات photons.
– علاوة على ذلك فإن الطاقة فى الضوء هي مجموع طاقات الفوتونات المنفردة وبذلك فهي مكماة quantized.
– ويحدث التأثير الكهروضوئي عندما يرتطم فوتون لاكترون في المعدن.
– هذا الفوتون سيختفي وإن طاقته υλ ستنتقل إلى الإلكترون بحيث إن جزءاً من هذه الطاقة تمتصها الإلكترونات لاستخدامها فى التخلص من القوي التى تربطه بالمعدن.
– والطاقة الإضافية المتبقية تظهر بشكل طاقة حركية يحملها الإلكترون المنبعث. وحسب قانون حفظ الطاقة عندئذ نكتب كما يلي:
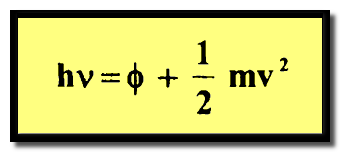
– حيث φ هي دالة الشغل work function وهي أقل طاقة يحتاجها الإلكترون للتخلص من المعدن.
– أما mv2 فهي الطاقة الحركية للإلكترون الطليق.
– وإذا كانت υλ < φ أي أن الفوتون له طاقة غير كافية فى السماح للإلكترون فى مغادرة المعدن ومن ثم لا يحدث التأثير الكهروضوئي.
(3) تفسير الخطوط الطيفية الذرية
– أن أخفاق الفيزياء الكلاسيكية فى تفسير ظاهرة إشعاع الجسم الأسود أحد أسباب ظهور نظرية الكم.
– عندما نضع غاز الهيدروجين في أنبوبة تحت ضغط مخلخل وتخضعه لتفريغ عالي الفولتية فسوف ينبعث ضوء.
– وعند مروره خلال منشور فسوف يتجزأ إلى سلسلة من الخطوط الطيفية كل منهما مرتبط بطول موجي أو تردد مختلف.
– ولم تتمكن النظرية الكلاسيكية من إعطاء قيم مضبوطة لترددات الخطوط الطيفية أو حتى قيم قريبة منها.
– وخلال الفترة من 1885 إلى 1910 توصل بالمر Balmer وريدبيرج Rydberg إلى إيجاد علاقة تجريبية تعطي الترددات المضبوطة لخطوط طيف الهيدروجين.
– ولم يوجد تفسير لهذه العلاقة التجريبية إلى أن جاء العالم بور عام 1913.
نظرية بور لتفسير الخطوط الطيفية الذرية
– بين العالم بور أن انبعاث ترددات معينة من الضوء من ذرات الهيدروجين يشير إلى أن ذرة الهيدروجين موجودة فقط فى حالات طاقية معينة.
– وبذلك فقد افترض بور الفروض الآتية :
(1) إن طاقة الهيدروجين توجد بشكل كمات، أي أن الذرة تتخذ طاقات منفصلة معينة فقط E3 , E2 , E1 , ……الخ.
– وقد سمى بور هذه الحالات المسموحة ذات الطاقة الثابتة بالحالات المستقرة stationary states للذرة (ولا يقصد بهذا التعبير على أن الإلكترون يكون عند سكون فى الحالة المستقرة).
(2) لا تنبعث من الذرة فى حالتها المستقرة أشعة كهرومغناطيسية.
(3) إذا حدث انتقال إلكترون من حالتها المستقرة Ea إلى أخري أقل طاقياً Eb فإن تردد الضوء المنبعث υ يعطى حسب قانون حفظ الطاقة كما يلي:
– وبصورة مشابهة يحدث انتقال إلكترون من حالة طاقية واطئة إلى أخرى أعلى طاقياً وذلك بامتصاص ضوء تردده معطى بالمعادلة (5-4).
– والآن عند ربط معادلتي (3) ، (4) نحصل على المعادلة الآتية كما يلي:
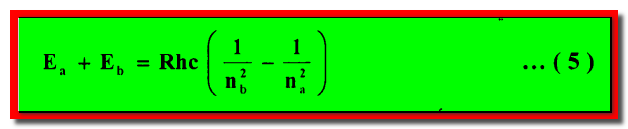
– وهذه المعادلة تشير بقوة إلى أن طاقات الحالات المستقرة لذرة الهيدروجين التى تعطي بالمعادلة كما يلي:

(4) يتحرك الإلكترون في ذرة الهيدروجين في مدار دائري حول ويخضع لقوانين الميكانيكا الكلاسيكية.
– وأن طاقة الإلكترون تساوي حاصل جمع طاقته الحركية وطاقة جهد التجاذب الكهروستاتيكي بين إلكترون-نواة.
– ووفقاً للميكانيكا الكلاسيكية تعتمد الطاقة على نصف قطر المدار. وطالما أن الطاقة هي مكممة (أى موجودة بشكل مضاعفات لـ كم ثابت) لذا يوجد فقط مدارات معينة مسموحة وقد استخدم بور فرضية أخري لاختيار المدارات المسموحة.
(5) أن المدارات المسموحة هي تلك التى تكون لها عزم الإلكترون الزاوي كما يلي:
حيث أن: π2/h=ђ
m ، v هما كتله وسرعة الإلكترون
r هو نصف قطر المدار
…… ,n = 1,2,3,4
نتائج فرضيات بور
– ومع هذه الفرضيات تمكن بور من اشتقاق التعبير التالي لمستويات الطاقة فى ذرة الهيدروجين

– حيث e شحنة الإلكترون وعند مقارنة معادلتي (6)، (7) ينتج لنا المعادلة الآتية كما يلي:

– كما أنه عند التعويض عن قيم m ، e ، h ، c فإننا سنحصل على قيمة ثابت ويدبيرج R منسجمة مع قيمته التجريبية (العملية) وهو دليل على أن بور قد أعطي مستويات طاقته مضبوطة لذرة الهيدروجين.









