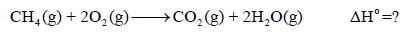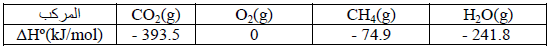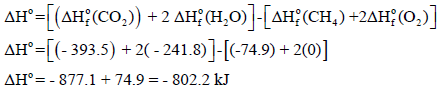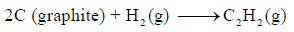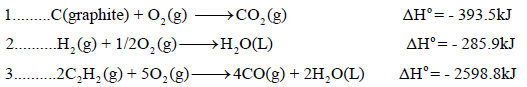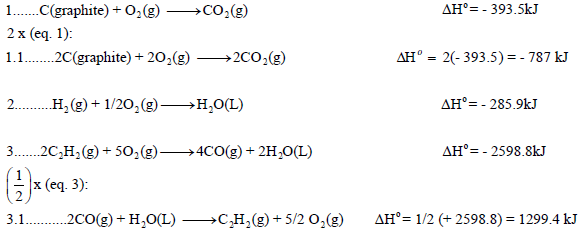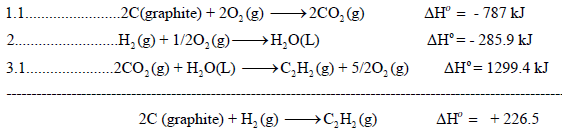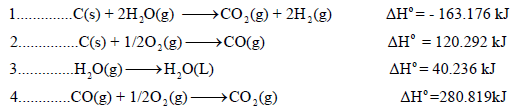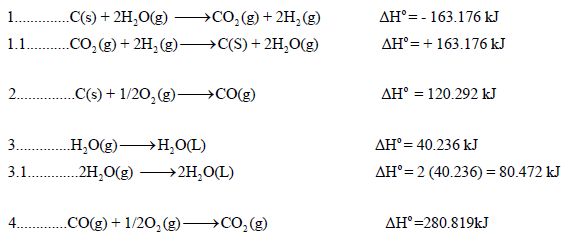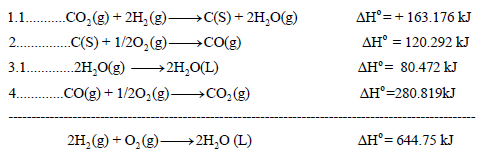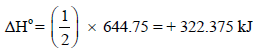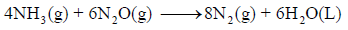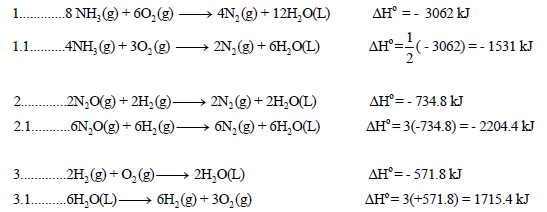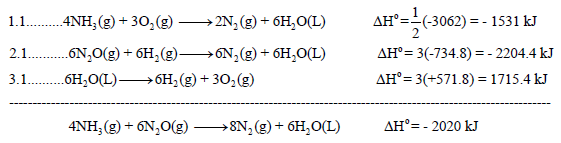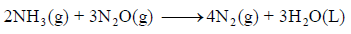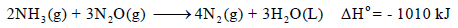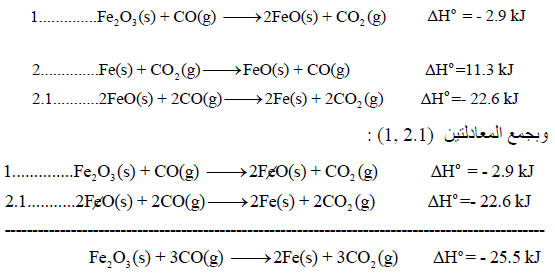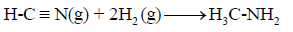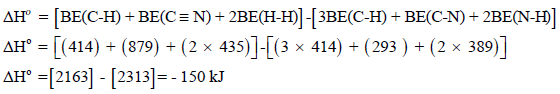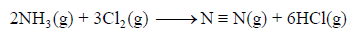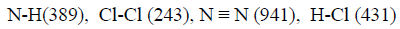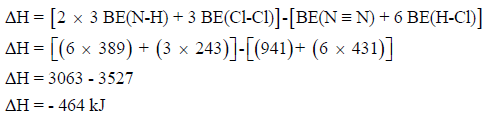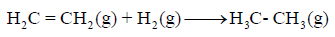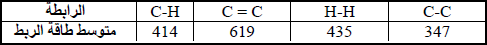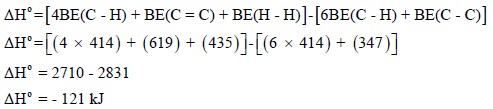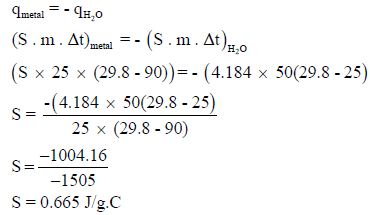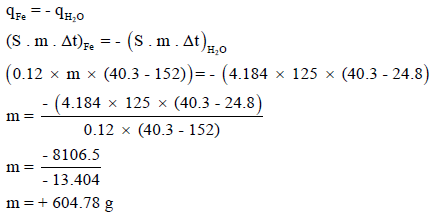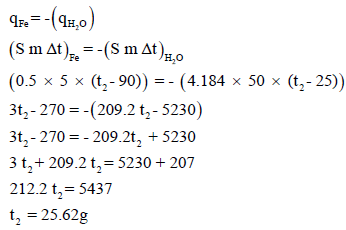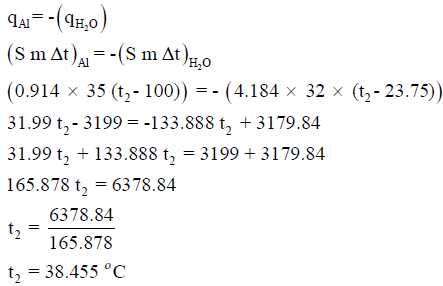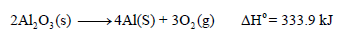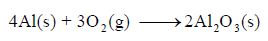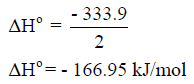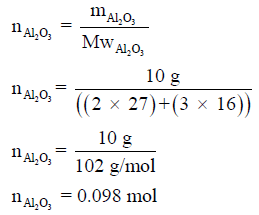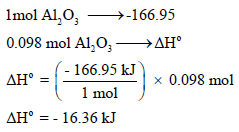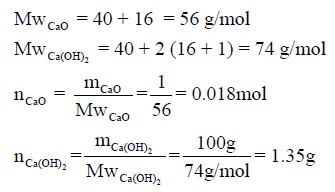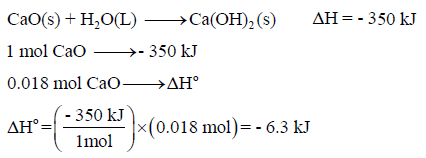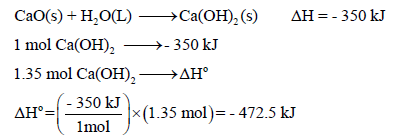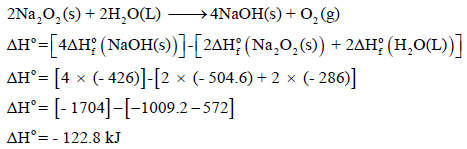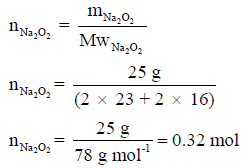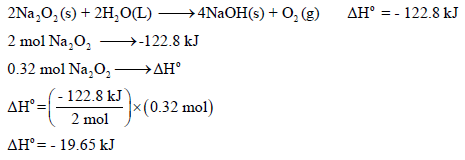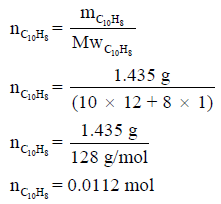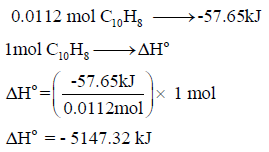مسائل محلولة على الكيمياء الحرارية Thermochemistry
في هذا الموضوع سنتناول (17) مسألة من مسائل محلولة على الكيمياء الحرارية Thermochemistry مع الإجابات التوضيحية والتفصيلية بالقوانين الرياضية
مثال (1): مسائل محلولة على الكيمياء الحرارية Thermochemistry
احسب حرارة تفاعل احتراق المیثان:
إذا علمت أن حرارات التشكل (التكوین) القیاسیة للمواد المتفاعلة والناتجة عن التفاعل ھي:
الحل:
مثال (2):
احسب قيمة ΔHο للتفاعل التالي:
إذا علمت أن:
الحل:
نقوم بعمل التعدیلات اللازمة على التفاعلات السابقة من أجل أن یعطي مجموعھا المعادلة الرئیسية:
وبجمع المعادلات التي طرأ علیھا تغییر(1.1 , 3.1) والتي لم تتغير (2) نحصل على:
مثال (3):
احسب قيمة ΔHο للتفاعل التالي:
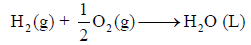
إذا علمت أن:
الحل:
وبجمع المعادلات التي تغيرت والتى لم يطرأ علیھا أى تغيير (1.1 , 2 , 3.1 , 4) نحصل على:
أي لاثنین مول من الماء وبالتالي فإنه لحساب التغیر في الإنثالبي لتكون مول واحد من الماء أي للمعادلة التالیة:
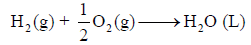
فإن قیمة حرارة التفاعل ھي:
مثال (4):
احسب قيمة ΔHο للتفاعل التالي:
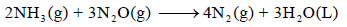
علماً بأن:
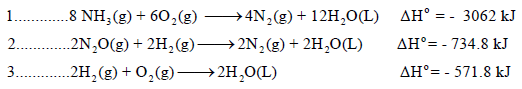
الحل:
للتبسیط نضرب المعادلة الرئیسية باثنین لتصبح:
وبإجراء التعدیلات اللازمة على المعادلات كالتالي:
وبجمع المعادلات التي طرأ عليها تغيير (1.1 , 2.1 , 3.1) نحصل على:
وللحصول على حرارة التفاعل للمعادلة الرئیسية:
نقسم القیمة على اثنین أي تصبح حرارة التفاعل:
مثال (5): مسائل محلولة على الكيمياء الحرارية Thermochemistry
احسب قيمة ΔHο للتفاعل التالي:
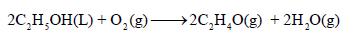
علماً بأن:
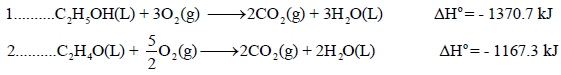
الحل:
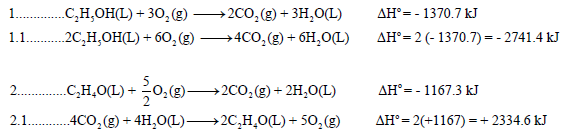
وبجمع المعادلتين (1.1 , 2.1) نحسب التغير في الانثالبي للتفاعل الرئيس (المطلوب):
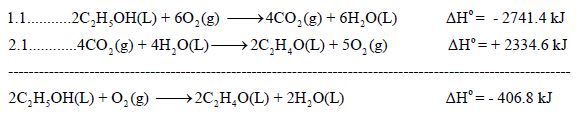
مثال (6):
احسب قيمة ΔHο للتفاعل التالي:
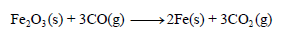
علماً بأن:
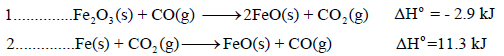
الحل:
مثال (7): مسائل محلولة على الكيمياء الحرارية Thermochemistry
احسب قيمة ΔHο للتفاعل التالي:
إذا علمت أن متوسط طاقة الربط بوحدة :kJ/mol
الحل:
مثال (8):
احسب قيمة ΔHο للتفاعل التالي:
إذا علمت أن متوسط طاقة الربط بوحدة :kJ/mol
الحل:
مثال (9):
احسب قيمة ΔHο للتفاعل التالي:
إذا علمت أن متوسط طاقة الربط بوحدة :kJ/mol
الحل:
مثال (10): مسائل محلولة على الكيمياء الحرارية Thermochemistry
إذا أضيفت 25 g من معدن عند درجة حرارة 90 Co إلى 50 g من الماء عند درجة حرارة 25 Co فإن درجة حرارة الماء ترتفع إلى 29.8 Co فإذا علمت أن الحرارة النوعية للماء تساوي 4.184 J/g.Co فاحسب الحرارة النوعية للمعدن.
الحل:
كمية الحرارة المفقودة من قبل المعدن = – كمية الحرارة المكتسبة
مثال (11):
نقلت قطعة من الحديد الصلب من الفرن عند 152 Co وغمرت في 125 g من الماء عند درجة حرارة 24.8 Co فارتفعت درجة الماء إلى 40.3 Co فما هي كتلة قطعة الصلب. علماً بأن الحرارة النوعية للحديد الصلب تساوي 0.12 J/g.Co والحرارة النوعية للماء تساوي 4.184 J/g.Co
الحل:
كمية الحرارة المفقودة = – كمية الحرارة المكتسبة
مثال (12): مسائل محلولة على الكيمياء الحرارية Thermochemistry
وضعت 5 g من الحديد حرارته 90 Co وحرارته النوعية 0.12 J/g.Co في إناء يحتوي على 50 g من الماء 25 Co وحرارته النوعية 4.184 J/g.Co فاحسب درجة الحرارة النهائية.
الحل:
كمية الحرارة المفقودة من قبل المعدن = – كمية الحرارة المكتسبة
مثال (13):
ألقيت قطعة من الألومنيوم وزنها 35 g ودرجة حرارتها 100 Co في 32 g من الماء درجة حرارتها 23.75 Co فما هي درجة الحرارة النهائية للماء إذا علمت أن الحرارة النوعية للألومنيوم تساوي 0.914 J/g.Co والحرارة النوعية للماء تساوي 4.184 J/g.Co
الحل:
كمية الحرارة المفقودة = – كمية الحرارة المكتسبة
مثال (14):
إذا أعطيت التفاعل التالي:
(أ) احسب حرارة تكوين مول واحد من Al2O3 الصلب
(ب) احسب حرارة تكوين (10 g) من Al2O3 الصلب علماً بأن الكتل الذرية (Al = 27 , O =16)
الحل:
(أ) المعادلة في السؤال تمثل تكوین الألمونيوم الصلب ولا تمثل تكوین Al2O3 الصلب. لذلك فإن المعادلة الممثلة لتكوینھ ھي عكس المعادلة السابقة أي :
ومنه فإن كمیة الحرارة الناتجة عن تكوین 2mol Al2O3 كمیة الحرارة لمول واحد فإننا نقسم ھذه الكمیة على 2:
(ب) حساب حرارة تكوين (10 g) من Al2O3 الصلب: لحل هذة المسألة لابد من تحويل الكمية بالجرامات إلى الكمية بالمولات
وبالتالي فإن كمية الحرارة الناتجة من تكون 0.098mol Al2O3 هي:
مثال (15): مسائل محلولة على الكيمياء الحرارية Thermochemistry
لدیك التفاعل التالي :
(أ) احسب حرارة التفاعل لجرام واحد من CaO
(ب) احسب حرارة التفاعل المصاحبة لإنتاج (100 g) من Ca(OH)2 علماً بأن الكتل الذرية (Ca = 40 , O =16 , H=1)
الحل:
في الفقرتین (أ، ب) نحول الكمیة بالجرام إلى الكمیة بالمولات :
(أ) حرارة التفاعل لجرام واحد من CaO ( 0.018 mol):
(ب) حرارة التفاعل المصاحبة لإنتاج (100 g) من Ca(OH)2 (1.35 mol):
مثال (16):
(أ) احسب قيمة التغير في الإنثالبي التالي:
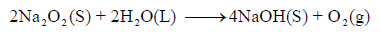
إذا علمت أن:
(ب) احسب كمية الحرارة المنطلقة من تفاعل 25 g من Na2O2 ؟
علماً بأن الكتل الذرية (Na = 23 , O =16)
الحل:
(أ) حساب قیمة التغیر في الإنثالبي للتفاعل:
(ب) نحول أولاً كمیة المادة بالجرامات الى كمیة المادة بالمولات كما یلي:
ولحساب كمیة الحرارة المنطلقة من (0.32 mol) 25 g Na2O2:
مثال (17): مسائل محلولة على الكيمياء الحرارية Thermochemistry
إذا احترقت كمية من النفثالين C10H8 في مسعر عند حجم ثابت يحتوي على 2000 g من الماء ، فإن درجة الحرارة ترتفع من 20.17 إلى 25.84 Co فإذا علمت أن السعة الحرارية للمسعر تساوي 4.184 J/g.Co والسعة الحرارية للماء تساوي 4.184 J/g.Co (الكتل الذرية: C=12 , H=1).
(أ) احسب الحرارة المنطلقة نتیجة احتراق 1.435 g من النفثالین.
(ب) احسب كمیة الحرارة الناتجة من احتراق مول واحد من النفثالین.
الحل:
(أ) نحول كمیة المادة من جرامات الى مولات:
وبتطبیق العلاقة :
كمیة الحرارة المفقودة = – (كمیة الحرارة المكتسبة من قبل المسعر + كمیة الحرارة المكتسبة من قبل الماء)
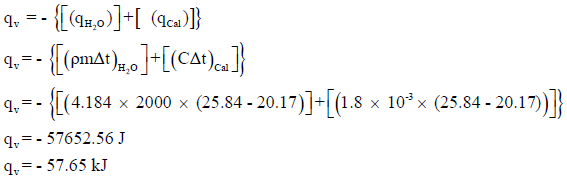
(ب) حساب كمیة الحرارة المنطلقة من احتراق مول واحد من النفثالین:
من المسألة في الفقرة (أ) السابقة فإن:
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية