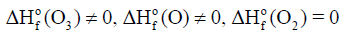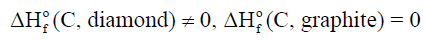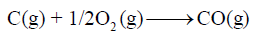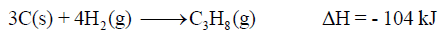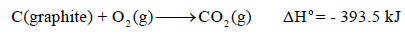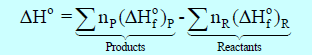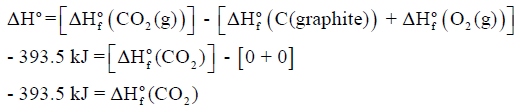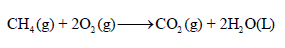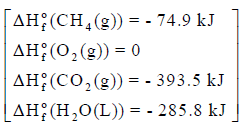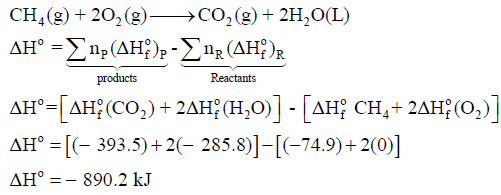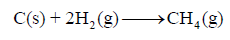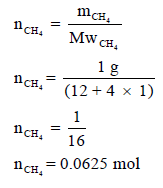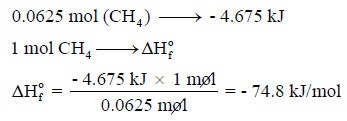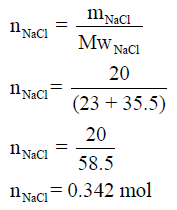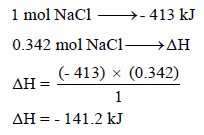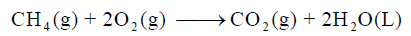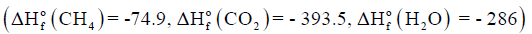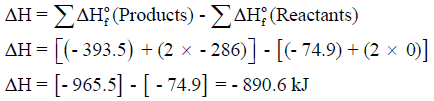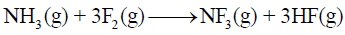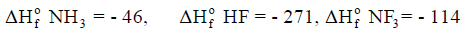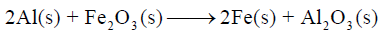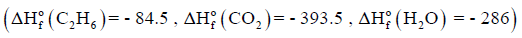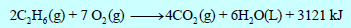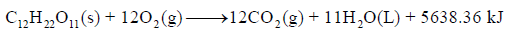حرارة التكوين Heat of Formation + مسائل محلولة
– في هذا الموضوع سيتم مناقشة حرارة التكوين Heat of Formation بالتفصيل وكذلك مسائل محلولة على حرارة التكوين وذلك للتوضيح.
محتويات الموضوع
حرارة التفاعل Heat of reaction
(1) حرارة التفاعل ھي محصلة تغیرات الطاقة الناتجة عن تحطیم وتكوین الروابط الكیمیائیة.
(2) حرارة التفاعل هي كمیة الحرارة التي تنطلق أو تمتص عندما یتفاعل عدد من الجزیئات مع بعضھا لینتھي التفاعل بالنواتج.
(3) بالإضافة إلى ذلك فأن حرارة التفاعل = الفرق بین حرارة المواد المتفاعلة ΔHreactant وحرارة المواد الناتجة ΔHproudct
– وقد یكون ھذا التغیر الحراري مصاحباً لعملیة تكوین مادة من عناصرھا الأولیة، وفي ھذه الحالة یسمى ذلك التغیر الحراري (حرارة التكوین).
– أو یكون ھذا التغیر الحراري مصاحباً لعملیة احتراق مادة ما فیسمى (حرارة الإحتراق)، أو یكون مصاحباً لعملیة تعادل بین حمض وقاعدة، فیسمى ( حرارة التعادل)، … وھكذا.
– وفي هذا الموضوع سوف نتناول نوع واحد فقط من هذه الأنواع وهو حرارة التكوين على أن نستكمل باقى الأنواع في الموضوعات القادمة.
تعريف حرارة التكوين Heat of Formation
– تعرف حرارة التكوين ΔHFo بأنھا حرارة التفاعل أو التغیر في الإنثالبي (المنطلقة أو الممتصة) عندما یتكون مول واحد من مادة ما من عناصرها الأولية وھي في حالتھا القیاسیة.
– وحدة قياس حرارة التكوين: kJ/mol
– ولقد اتفق أن قیم لجمیع العناصر في حالتھا القیاسیة تساوي صفراً
أمثلة توضيحية على حرارة التكوين
(1) الأكسجين
– یوجد الأكسجين على ثلاثة أشكال هي الأكسجين الذري (O) ، والأكسجين الجزيئي (O2) ، الأوزون (O3)
– ويعتبر الأكسجين (O2) الأكثر استقراراً عند (298K) وضغط جوي واحد (1 atm) وبالتالي فإن:
(2) الكربون
– یوجد الكربون على شكلین: جرافيت (graphite) وألماس (diamond)
– ویعتبر الجرافیت الأكثر استقراراً عند (298 K) وضغط جوي واحد ، وهذا يعني:
شروط كتابة معادلة حرارة التكوين
(1) المادة الناتجة ھي فقط مول من المادة المراد إیجاد حرارة التكوین لھا.
(2) المواد المتفاعلة ھي العناصر المكونة للمادة المراد إیجاد حرارة التكوین لھا. بشرط أن تكون ھذه العناصر في الحالة القیاسیة.
– فمثلاً لا یمكن استخدام التفاعل التالي لحساب حرارة التكوین لـ CO
وذلك لأن الكربون في حالته الطبیعیة یكون في حالة صلبة ولیست غازیة.
– وفيما يلي أمثلة توضيحية على كيفية كتابة معادلة حرارة التكوين كما يلي:
(1) حرارة التكوین لكلورید الھیدروجین HCl كما يلي:
(2) حرارة التكوین للماء H2O كما يلي:
(3) حرارة التكوین لأكسید الكربون CO كما يلي:
(4) حرارة التكوین لثاني أكسید الكربون CO2 كما يلي:
(5) حرارة التكوین لكبریتید الحدید FeS II كما يلي:
(6) حرارة التكوین للبروبان C3H8 كما يلي:
(7) حرارة تكوین النشادر (الأمونیا) NH3
(8) حرارة التكوین لكبریتات النحاس CuSO4
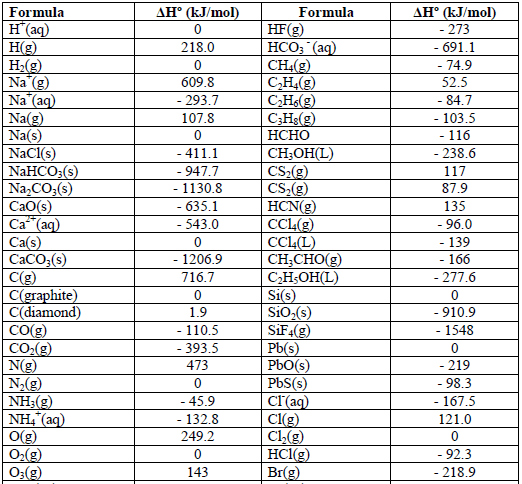
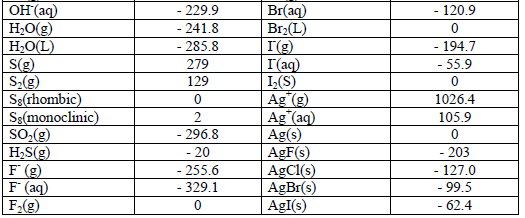
جدول حرارة التكوين القياسية ΔHFo
– جدول حرارة التكوين القياسية ΔHFo للعناصر والأيونات والمركبات كما يلي:
وفيما يلي ملاحظات على جدول حرارت التكوين السابق كما يلي:
(1) حرارة تكوین العناصر النقیة تساوي صفراً عند كل درجات الحرارة مثل:
(Cu(s), N2(g), Fe(s), Na(s), Cl2(g), Hg(L
(2) علاوة على ذلك فأن معظم حرارة التكوين سالبة وهذا يعني أن تكوين المركب من عناصره الأولية في الغالب طارد للحرارة.
(3) المركبات التي يصاحب تكوينها طرد للحرارة تكون أكثر استقراراً (علل) وذلك لأن المحتوي الحراري للمركب الناتج أقل من مجموع المحتويات الحرارية للعناصر الداخلة في تركيبه كما في CH3OH , CH4 ، …….
(4) كلما زادت الطاقة المنطلقة زاد ثبات المركب الناتج (یصعب تفكیكه) كما يلي:
– وكلما زادت الطاقة الممتصة كلما قل ثبات المركب (سھل تفكیكه) كما يلي:
مسائل محلولة على حرارة التكوين القياسية
مثال (1)
لديك التفاعل الآتي كما يلي:
وفيه حرارة التفاعل القياسية ΔHo (التغير في الإنثالبي القياسي) یساوي مجموع حرارات التكوین القیاسیة لجمیع المواد الناتجة مطروحاً منه مجموع حرارات التكوین القیاسیة لجمیع المواد المتفاعلة، كما يلي:
P تعني Products أي النواتج
R تعني Reactants أي المتفاعلات .
ΔHo: حرارة التفاعل
np= عدد المولات لأى مادة ناتجة
nR= عدد مولات لأى مادة متفاعلة .
)pΔHFo) = حرارة التكوین لمول واحد من المادة الناتجة
)RΔHFo) = حرارة التكوین لمول واحد من المادة المتفاعلة
– وبالتالي فإنه للتفاعل:
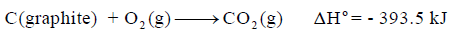
وھذا یعني أن حرارة التفاعل القیاسیة ΔHο تساوي حرارة التكوین القیاسیة للمركب CO2(g)
مثال (2)
احسب حرارة التفاعل ΔHo التالي:
علماً بأن أنثالبى التكوين كما يلي:
الحل:
بتطبیق العلاقة على التفاعل كما يلي:
مثال (3)
عند تكون 1 g من CH4 من عناصره الأولية عند الظروف القياسية ينطلق 4.675KJ فاحسب حرارة التكوين القياسية للميثان بوحدة KJ:
(علماً بأن الكتل الذرية : H =1 , C =12)
الحل:
– حینما یطلب في المسألة حساب حرارة التكوین القیاسیة فإنه یعني حرارة التكوین الناشئة من تفاعل مول واحد من المادة.
– وفي المسألة أعطینا حرارة التكوین لـ 1 g من الميثان ، وبالتالي نحولها إلى مولات كما يلي:
وبالتالي:
مثال (4)
إذا علمت أن طاقة تكوین كلورید الصودیوم تساوي (-413 kJ/mol) فاحسب الطاقة المنطلقة عند تكوين 20 g من NaCl
(علماً بأن الكتل الذرية كما يلي : Na =23 , Cl =35.5)
الحل:
نحسب مولات 20 g من NaCl كما يلي:
وبالتالي فإن:
مثال (5)
احسب طاقة التفاعل التالي:
علماً بأن طاقة التكوین بوحدة KJ كما يلي:
الحل:
مثال (6)
احسب طاقة التفاعل التالي:
علماً بأن طاقة التكوین بوحدة KJ كما يلي:
الجواب النهائي: – 881 KJ
مثال (7)
لديك التفاعل التالي:
احسب طاقة التفاعل علماً بأن طاقة تكوين Al2O3 تساوي (-1676 KJ) وطاقة تكوين Fe2O3 تساوي (-822.7 KJ)
الجواب النهائي: – 853.7 KJ
مثال (8)
حسب المعادلة الآتية كما يلي:
علماً بأن طاقة التكوین بوحدةkJ/mol كما یلي:
(ا) أحسب طاقة التفاعل
(ب) أكتب المعادلة الكيميائية الحرارية
(ج) أحسب طاقة احتراق مول واحد من C2H6
الجواب النهائي:
(أ) طاقة التفاعل = -3121 KJ
(ب) المعادلة الكيميائية الحرارية:
(ج) طاقة احتراق مول واحد من C2H6 = ΔH = – 1560.5 kJ
مثال (9)
حسب المعادلة الآتية كما يلي:
احسب طاقة تكوين C12H22O11 علماً بأن طاقة تكوين الماء تساوي (-286 KJ/mol) ولثاني أكسيد الكربون تساوي (-393.5 KJ)
الجواب النهائي: – 2229.64 KJ
المراجع – أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية