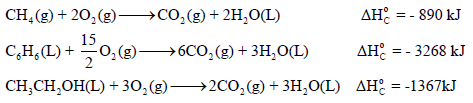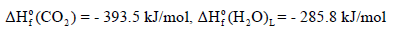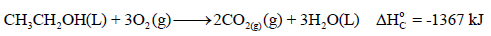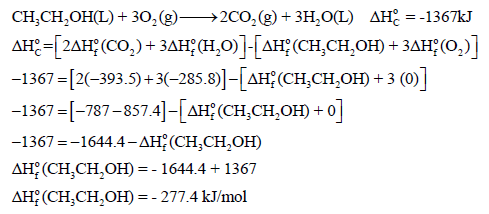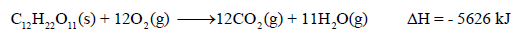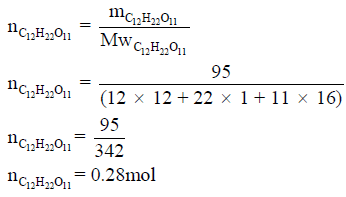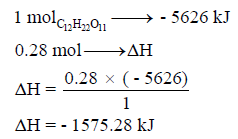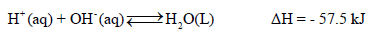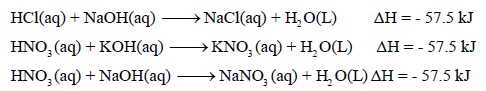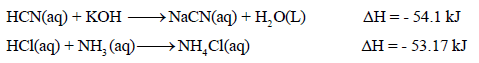حرارة الإحتراق وحرارة التعادل + مسائل محلولة
– في هذا الموضوع سيتم مناقشة حرارة الإحتراق وحرارة التعادل Heat of Combustion and Heat of Neutralization مع الامثلة والتمارين والمسائل المحلولة للتوضيح.
محتويات الموضوع
حرارة الإحتراق Heat of Combustion
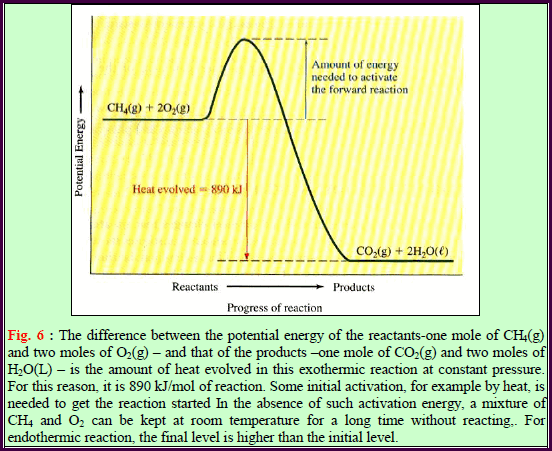
– تعرف حرارة الإحتراق القیاسیة بأنھا الحرارة الناتجة (المنطلقة) من احتراق مول واحد من مركب ما في حالته القیاسیة احتراقاً كاملاً في جو من الأكسجین (وفرة من الأكسجین) عند درجة حرارة (25 Co) وضغط ( 1 atm)
– ویرمز لحرارة الإحتراق بالرمز (ΔHCo) وحیث أن الحرارة تنطلق نتیجة الإحتراق فإن قيم (ΔHCo) تكون سالبة.
– عند احتراق المواد التي تحتوي على كربون وھیدروجین فقط احتراقاً كاملاً فإنھا تنتج فقط ثاني أكسید الكربون والماء.
– یجب أن یوجد الأكسجین بكمیة كافیة في التفاعل (تفاعل الاحتراق) لیتحول جمیع الكربون والھیدروجین الى ثاني أكسید الكربون وماء.
أمثلة لتفاعلات الإحتراق
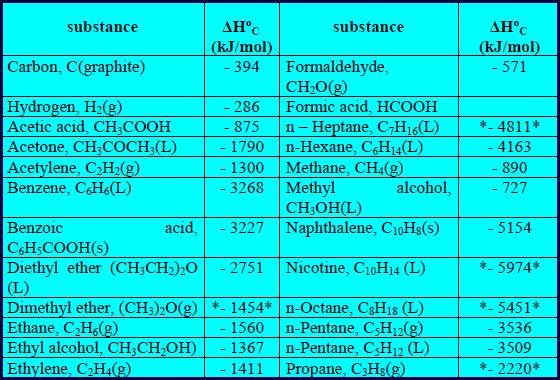
– الجدول التالي يوضح قیم حرارة الإحتراق لبعض المركبات عند 298 K كما يلي:
– ویمكن استخدام قیمة حرارة احتراق مركب ما لحساب حرارة التكوين له كما یتضح من المثال التالي:
مسائل محلولة على حرارة الإحتراق
مثال (1): إذا علمت أن حرارة احتراق الكحول الإیثیلي (C2H5OH) تساوي (-1367KJ) عند درجة حرارة (298 k). أحسب حرارة تكوينه من عناصره الأولية عند هذه الدرجة إذا كانت حرارتي تكوين ثاني أكسيد الكربون والماء هما كما يلي:
الحل:
معادلة التفاعل ھي كما يلي:
وبتطبیق المعادلة كما يلي:
على التفاعل:
مثال (2): يحترق السكر الصلب (C12H22O11) في كمية من الأكسجين لينتج غاز ثاني أكسيد الكربون والماء السائل وذلك عند درجة حرارة 25 Co ، وتنطلق كمية من الحرارة مقدارها 5626 kj/mol
احسب كمیة الحرارة الناتجة من حرق 95 g من السكر الصلب؟ (علماً بأن الكتل الذرية : H =1 , C =12, O = 16)
الحل:
نحول كمیة السكر بالجرامات الى مولات كما یلي:
وبالتالي:
حرارة التعادل Heat of Neutralization
– حرارة التعادل ھي كمیة الحرارة الناتجة من تكوین مول واحد من الماء من تعادل حمض مع قاعدة.
– أو ھي كمیة التغیر في المحتوى الحراري عندما يتعادل واحد جرام مكافئ من الحمض مع واحد جرام مكافئ من القاعدة في المحالیل المخففة.
– والمقصود بالمحالیل المخففة ھي تلك المحالیل التي تحتوي على كمیة كبیرة من الماء. حیث تكون المواد المتفاعلة والناتجة من التفاعل ثابتة التفكك. ومحصلة التفاعل ھي ببساطة عملیة تكوین الماء غیر المتفكك.
أولاً/ قیم حرارة التعادل للأحماض والقواعد القویة
– ومن الثابت أن قیم حرارة التعادل للأحماض والقواعد القویة واحدة وثابتة بغض النظر عن نوع الحمض القوي أو القاعدة القوية المستخدمة في عملية التعادل
– قيمة حرارة التعادل للأحماض والقواعد القوية تساوي (-57.5KJ). وسبب ثباتها تقريباً لأن حرارة التعادل في الأصل ھي حرارة تكوین مول واحد من الماء. حيث أن التفاعل الحقيقى بين حمض وقاعدة قويين في عملية التعادل هو اتحاد أيونات الهيدروجين (H+) وأيونات الهيدروكسيد (OH–) لتكوين الماء.
– أمثلة على هذا النوع كما يلي:
ثانياً/ قيم حرارة تعادل الأحماض والقواعد الضعیفة
– في حالة تعادل الأحماض والقواعد الضعیفة (غير تامة التفكك) فإن حرارة التعادل الناتجة سوف تختلف عن المقدار (-57.5kj) لأن التفاعل سوف يشتمل على عملية تفكك الحمض الضعيف والقاعدة الضعيفة (تفاعل ماص للحرارة) ، وعملية تكوين الماء من أيونات (H+) و (OH–) (تفاعل طارد للحرارة)
– وتكون حرارة التعادل في ھذه الحالة ھي محصلة العملیتین السابقتین، وبالتالي فإن حرارة التعادل في حالة الأحماض والقواعد الضعیفة سوف تتوقف على نوع الحمض أو القاعدة الضعیفة.
– أمثلة على هذا النوع كما يلي:
المراجع – أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي. ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية