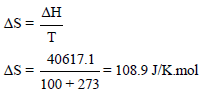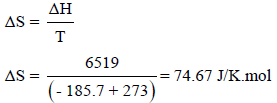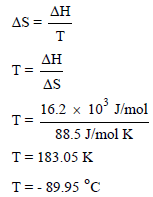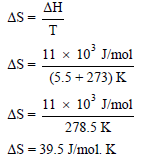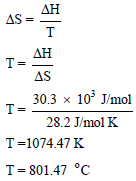القانون الثاني في الثيرموديناميك (الديناميكا الحرارية)
فى هذا الموضوع أن شاء الله سوف نقوم بشرح القانون الثاني للديناميكا الحرارية (الثيرموديناميك)
القانون الثاني في الثيرموديناميك
– ویمكن للقانون الثاني فى الثيرموديناميك The Second Law of Thermodynamics أن یصاغ بصیاغات أخرى من أھمھا:
(1) صیغة بلانك:
وتنص على أنه: لا یمكن تركیب آلة تعمل على خطوات لتحویل حرارة إلى شغل بدون أن تفقد جزءاً من ھذة الحرارة أو أن تكون هناك تأثیرات جانبیة.
(2) صیغة كلفن:
وتنص على أنه: من المستحیل استعمال العملیة الدائریة لنقل الحرارة من مستودع حراري وتحویل ھهذه الحرارة إلى شغل وبدون نقل كمیة معینة من الحرارة من جسم ذي درجة حراریة عالیة إلى جسم ذي درجة حراریة منخفضة وبنفس الوقت.
(3) صیغة كلاسیوس:
وتنص على أنه: من المستحیل استعمال العملیات الدائریة لنقل الحرارة من جسم ذي درجة حراریة منخفضة إلى جسم آخر درجة حرارته عالیة بدون تحویل كمیة معینة من الشغل إلى حرارة.
– ومثل هذه الصیاغات للقانون الثاني لا یمكن تطبیقھا مباشرة في الإجابة على السؤال فیما إذا كان من الممكن حدوث تفاعل كیمیائي معین أو عملیة فیزیائیة معینة تلقائیاً أم لا. لذلك یلزم تقدیم دالة ثیرمودینامیكیة جدیدة لھذا الغرض وهذه الدالة ھي الأنتروبي (S).
(4)نص القانون الثاني في الثيرموديناميك وفقًا لدالة الأنتروبي:
– یرتبط القانون الثاني للدینامیكا الحراریة بمفھومنا عن التغیرات في الأنتروبي ویقول إن الكمیة الكلیة لانتروبي الكون في ازدیاد. ویمكننا تعریف الكون بأنه مؤلف من نظام كیمیائي معین تحت الاختبار والجزء الباقي من المحیط الكوني.
– ینص القانون الثاني وفقاً للأنتروبي على أن:
كل تغیر تلقائي لا بد وأن ترافقه زیادة في الأنتروبي وتبقى ثابتة في حالة التوازن.
أو بعبارة أخرى:
عندما یتم أي تغیر تلقائي في نظام معین تكون ھناك زیادة في أنتروبي الكون.
بمعنى أن التغیر الكلي في الأنتروبي (ΔSt) ھو الذي یحدد كون العملیة تلقائیة أم لا.

الطاقة والأنتروبي
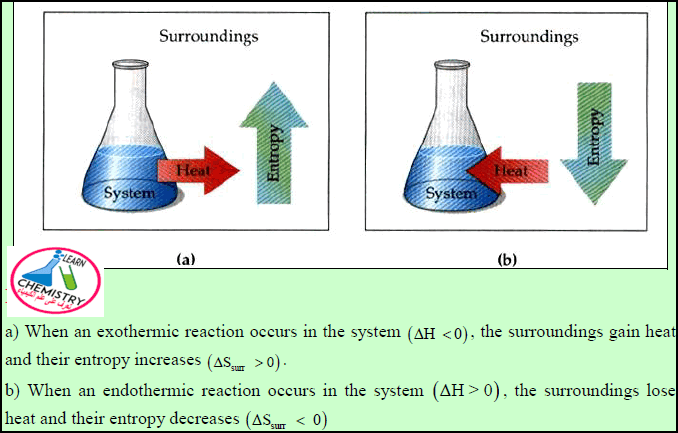
الطاقة لا تفنى ولا تستحدث أي تبقى ثابتة حسب قانون حفظ الطاقة خلال التغیرات الكیمیائیة أو الفیزیائیة، بینما تصاحب هذه التغیرات زیادة في قیمة الأنتروبي.
الصيغة الرياضية للقانون الثاني في الثيرموديناميك
– التغیر في الأنتروبي (ΔSt) عبارة عن مجموع التغیر في أنتروبي النظام (ΔSs) والتغير في أنتروبي المحيط (ΔSr)
– وحسب القانون الثاني فإن التغیر الكلي في الأنتروبي (ΔSt) كمیة موجبة لأي عملیة تلقائیة:
– أما عند التوازن:
وبالتالي عندما (ΔSt = +) يكون التفاعل تلقائياً.
– مما سبق یتبین أن قیمة التغیر في الأنتروبي للنظام فقط قد لا تساعدنا بشكل كامل في التعرف على تلقائیة التفاعل، وحیث أنه یصعب في كثیر من العملیات الحصول على التغیر في الأنتروبي للمحیط، لذلك سنلجأ (كما سنأخذ لاحقاً) لخاصیة ثیرمودینامیكیة (وھي التغیر في الطاقة الحرة) التغیر في طاقة جبس الحرة ΔG والتي یمكن ایجادھا بالقانون التالي:
مثال توضيحي على القانون الثاني في الثيرموديناميك
– نفرض أن لدینا نظاماً ثیرمودینامیكیاً لا یحدث فیه تغیر كیمیائي أو فیزیائي (بما في ذلك الضغط أو المزج) وتنساب إلیه كمیة من الحرارة مقدارھا q)) فإن أنتروبي النظام سوف یزداد بمقدار:
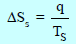
حيث Ts درجة الحرارة المطلقة للنظام.
والتغير في حرارة المحيط هو (-q) وبالتالي فإن أنتروبي المحیط:
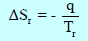
حيث (Tr) درجة الحرارة المطلقة للمحیط.
– ویكون التغیر الكلي في الأنتروبي ھو مجموع حاصل جمع التغیر في أنتروبي النظام أو التغیر في أنتروبي المحیط:
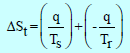
(1) إذا كانت (Ts) أقل من (Tr)
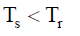
فإن التغیر الكلي في الأنتروبي (ΔSt) يكون موجباً (+) أي أن الحرارة تنساب من المنطقة الساخنة إلى الباردة (أي من المحيط إلى النظام).
(2) إذا كانت (Ts) أكبر من (Tr)
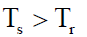
فإن التغیر الكلي في الأنتروبي (ΔSt) يكون سالباً (+) أي أن الحرارة لا يمكن تنساب من المنطقة الباردة إلى الساخنة بشكل تلقائي.
– ویستنتج مما سبق أن:
(1) قیمة الأنتروبي الموجبة تعني أن العشوائیة زادت وبالتالي فإن العملیة تلقائیة.
(2) قیمة الأنتروبي السالبة تعني أن الانتظام قد زاد وبالتالي فإن العملیة غیر تلقائیة.
(3) من العلاقة:
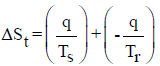
كمية الحرارة المفقودة من النظام (qs) تساوي كمية الحرارة المكتسبة بواسطة (qr) وبالتالي فإن درجة الحرارة المطلقة للمحيط والنظام هما فقط اللذان يتحكمان في قيمة التغير الكلي للأنتروبي (ΔSt)
تغير الأنتروبي في التحولات الفيزيائية Entropy Change in Physical Transformation
– تغیر الأنتروبي بالإضافة إلى مرافقته التغیر في درجة حرارة النظام، فإنه یرافق أیضاً التحولات الفیزیائیة مثل الإنصھار أو التبخر أو التحول من شكل بلوري إلى آخر.
– ویكون الأنتروبي في هذه التحولات الفیزیائیة:
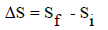
– عند ذوبان مادة صلبة أو تبخر سائل فإن درجة حرارة النظام تبقى ثابتة ولكن الأنتروبي یزداد (علل) لأنه أصبح لدى الجسیمات المكونة للنظام حریة أكبر لكي تتحرك.
مثال توضيحي
إذا حدث تغیر فیزیائي نتیجة امتصاص أو انطلاق مقدار (ΔH) من الحرارة من قبل كمیة معینة من مادة فإن التغیر في الأنتروبي لمثل ھذه العملیات:
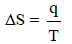
وعند ضغط ثابت فإن: qp =ΔH
أي أن التغیر في الأنتروبي یعطي نتیجة لحاصل قسمة الحرارة اللازمة لإنجاز ھذا التحول على درجة الحرارة التي حدث عندھا التحول (درجة الغلیان أو الإنصھار).
ملحوظة هامة
المعادلة:
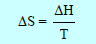
تكون ساریة المفعول فقط إذا كانت حالة التوازن مستمرة خلال التحول (مثل الإنصھار، الغلیان، التسامي، التبخر)، أو أن التوازن موجود بین الحالتین.
حیث أنه عند التوازن فإن قیمة التغیر في طاقة جبس الحرة تساوي صفراً (ΔG = 0) ومن العلاقة:
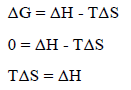
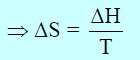
مسائل محلولة على القانون الثاني للثيرموديناميك
مثال (1): احسب التغیر في الأنتروبي ΔS للتحول التالي:
عند ضغط جوي واحد، ودرجة غلیان الماء العادیة (100 Co)
الحل:
مثال (2): احسب التغیر في الأنتروبي المرافق لتبخر مول واحد من غاز (Ar) إذا علمت أن التغیر في الأنثالبي ΔH للتبخير يساوي (6519 J/mol) عند درجة غليان الآرجون الإعتيادية (-185.7 Co) وهل هذا التغير زيادة في الأنتروبي أو نقص؟
الحل:
لحساب التغیر في الأنتروبي نتبع العلاقة:
وتدل قیمة التغیر في الأنتروبي الموجبة على أن أنتروبي الآرجون قد ازداد بمقدار 74.5 J/K.mol
مثال (3): حرارة تسامي ثاني أكسيد الكربون CO2 هي 16.2 kJ/mol وقيمة الأنتروبي للتسامي هو 88.5 J/mol.K ما درجة الحرارة التي يتسامي عندها CO2؟
الحل:
أي أن CO2 يصبح غازاً عند درجة حرارة تحت الصفر (- 89.95 Co)
مثال (4): إذا كانت حرارة انصھار البنزین تساوي 11 kJ/mol احسب التغیر في الأنتروبي ΔS عندما یتحول البنزین من الحالة الصلبة الى الحالة السائلة، علماً بأن درجة انصھار البنزين (5.5 Co)
الحل:
مثال (5): الحرارة اللازمة لصھر كلورید الصودیوم NaCl هي 30.3 kJ/mol والزيادة في الأنتروبي هي 28.2 J/mol.K احسب درجة الإنصھار؟
الحل:
المراجع
– أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية