اللزوجة Viscosity – موضوع شامل ومفصل
محتويات الموضوع
تعريف اللزوجة Viscosity
– اللزوجة: ھي مقاومة السائل للإنسیاب (مقیاس لسرعة سریان السائل بتأثیر قوى معینة) حیث تبدي جمیع السوائل مقاومة معینة للسریان، تختلف من سائل لآخر.
– فالماء أسرع في سریانه من الجلسرین، وبذلك یعد الماء أقل لزوجة من الجلسرین (عند نفس درجة الحرارة، كذلك فإن الماء أقل لزوجـة من العسل.
– كما أن هناك العديد من القیاسات المھمة في الصفات الفیزیائیة للسوائل ھي: الضغط البخاري ، التبخر، درجة الغلیان، التوتر السطحى ، اللزوجـة ، الانكسار الضوئي ، النشاطیة الضوئیة، العزم الزاوي.
أسباب نشأة اللزوجة Viscosity
– تنشأ اللزوجة من قوى الاحتكاك بین طبقات السائل في أثناء حركتھا لبعضھا البعض (سببھا وجود قوى تجاذب (تماسك) بین جزیئات السائل تسبب احتكاكاً داخلیاً).
– ویكون ھذا التأثیر ضعیفاً في المحالیل ذات اللزوجـة المنخفضة كالكحول الإیثیلي والماء ذات الانسياب السھل (السریع). المحالیل الأخرى كعسل النحل أو زیوت المحركات ذات اللزوجـة العالیة فیكون انسیابھا بطیئاً إلى حد كبیر.
– كذلك یمكن القول بأن احتكاك الطبقات المتجاورة في الجلسرین أكبر من احتكاك الطبقات المتجاورة في الماء، ولھذا تقل سرعة سریان الجلسرین عن سرعة سریان الماء ویصبح الجلسرین أكثر لزوجـة من الماء.
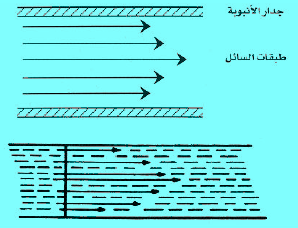
– وإذا فرضنا أننا وضعنا سائلاً في أنبوبة ضیقة وأثرنا علیه بقوة ما مثل فرق في الضغط بین طرفي الأنبوبة، فإن السائل یبدأ في السریان في الأنبوبة، ولكن السرعة التي تتحرك بھا طبقات ھذا السائل تختلف من طبقة إلى أخرى.
– فالطبقة الرقیقة الملامسة لجدار الأنبوبة تكون ساكنة تقریباً، وتتزاید سرعة حركة الطبقات كلما بعدنا عن جدار الأنبوبة، وتصل ھذه السرعة إلى أقصاھا في الطبقات الوسطى من السائل، ثم تقل بعد ذلك تدریجیاً حتى تصل إلى جدار الأنبوبة المقابل (انظر الشكل التالي)
القوانين الرياضية المتعلقة باللزوجة Viscosity
– وقد وجد من التجارب العلمیة أن قوى الاحتكاك(F) التي تضاد الحركة النسبية كطبقتین متلاصقتین واللازمة لكي یبقى ھناك فرق ثابت من سرعة الطبقتین المتتالیتین یتناسب طردیاً مع مساحة سطح التماس بین طبقتي السائل.
Fα S
dV/dxFα
حيث (V) السرعة و (X) المسافة التي تفصل الطبقتين.
بالجمع بين العلاقتين السابقتين نجد أن:
حيث η ثابت ويعرف بمعامل اللزوجة.
قوى الاحتكاك = معامل اللزوجـة × مساحة سطح التماس × (سرعة على المساحة)
ملاحظات هامة على اللزوجة Viscosity
– تعتمد سرعة الجزیئات وتدفق السوائل على درجة لزوجة السائل، فكلما زادت اللزوجة قلت سرعة الإنسیاب. فمثلاً الجلسرین أكثر لزوجـة من الماء، ولذلك فإن الماء أكثر انسیاباً من الجلسرین. كذلك زیوت المحركات انسیابھا بطيء مقارنة بالماء، ولذلك فھي أكثر لزوجـة من الماء.
– يتم تصنیع زیوت السیارات بدرجات مختلفة.وذلك للإستخدام وفق الفصل (صیف أم شتاء)، فالزیت ذو الدرجة العالیة یدل على ارتفاع لزوجته وبالتالي یصلح للإستخدام في فصل الصیف الذي یمتاز بارتفاع درجة حرارته. بینما في الشتاء تستخدم الزیوت ذات الدرجة المنخفضة.
– اللزوجة في السوائل أكبر منھا بكثیر عن الغازات بسبب زیادة قوى التجاذب في السوائل .
معامل اللزوجة Viscosity coefficient ووحدات قياسه
تعريف معامل اللزوجة (أو اللزوجة)
– هو القوة بالداين (dyne) التي تؤثر بين طبقتين متوازيتين من سائل، مساحة مقطع كل منهما (1 cm2) ويبعدان عن بعضها مسافة (1cm2) لكي تحفظ سرعة سريان إحدى الطبقتين بالنسبة للأخرى بسرعة قدرها .(1 cm/s)
– العلاقة بین معامل اللزوجة والحجم السائل الذي یمر خلال أنبوبة دقیقة (شعریة) ذات قطر (r)وطول (L) فى الزمن (t) بالثانية تحت ضغط (P) تعطى بعلاقة بوازيه Poisellieh كما يلي:
وحدات معامل اللزوجة
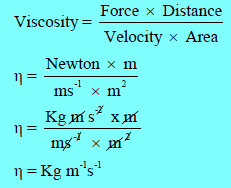
العوامل المؤثرة في اللزوجة
(1) درجة الحرارة
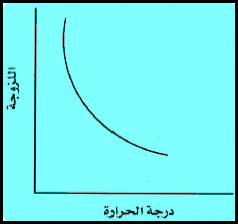
– تقل اللزوجـة بارتفاع درجة الحرارة ، لأن زیادة درجة الحرارة یزید من حركة الجزیئات فتقل نسبیاً قوى التجاذب بین الجزیئات، فإذا قل التجاذب قلت اللزوجـة.
– لذلك ینصح سائقوا السیارات باستخدام زیوت عالیة اللزوجـة في الصیف. وقلیلة اللزوجـة في الشتاء.
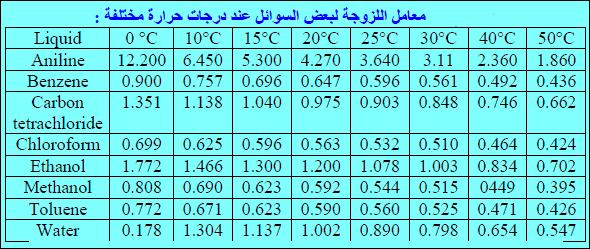
– وقد وجد أن لزوجة السائل تقل بمقدار (1-2%) لكل ارتفاع في درجة الحرارة مقداره (1Co).
– ما أثر ارتفاع درجة الحرارة على لزوجة السوائل؟
– تنقص لزوجة السوائل بارتفاع درجة الحرارة لأن ارتفاع درجة الحرارة یقلل من تأثیر قوى التجاذب (یزید من الطاقة الحركیة لجزیئات السائل) وھذا السلوك خلاف السلوك للغازات والتي معامل اللزوجـة لھا یزداد مع درجة الحرارة.
– وبرسم العلاقة كما يلي:
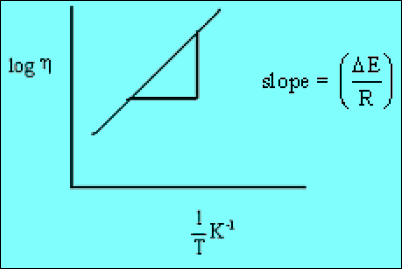
– حيث (ΔE): طاقة التنشیط لانسیاب اللزوجـة والتي یمكن تعیینھا من الشكل بواسطة المیل للخط المستقيم (ΔE/R)ھذه الطاقة الانتقالیة التي یجب وجودھا قبل حدوث التدفق.
– وھذا یعني أن الجزیئات یجب أن تأخذ طاقة كافیة لدفع الجزیئات المحیطة قبل أن تأخذ أي خطوة في عملیة سریان السائل .
(2) الوزن الجزیئي
– تزداد اللزوجـة بازدیاد حجم الجزیئ (الوزن الجزیئي) في المركبات المتجانسة (من نوع واحد).
– فمثلاً في الھیدروكربونات لزوجـة المركب C8H18 أكبر من C7H16
(3) قوى التجاذب
– قوى الجذب بین الجزیئات تعتبر مقیاس مبدئي للزوجة السوائل، فكلما زاد التجاذب بین الجزیئات تزداد صعوبة حركة الجزیئات وبالتالي تزداد لزوجة السائل. فمثلاً السوائل ذات الجزیئات القطبیة تكون أعلى لزوجة.
– وبالتالي فإن السوائل التي تمتاز جزیئاتھا بقوى تجاذب عالیة ذات لزوجـة عالیة.
(4) وجود مواد ذائبة
– المواد المذابة في السائل تؤثر في اللزوجة، فمثلاً وجود السكر في الماء یزید من لزوجـة الماء.
– أما وجود الأملاح الأیونیة في الماء فإنھا تقلل من لزوجـة الماء
– ووجود المواد العالقة في السائل یزید من لزوجته، فمثلاً الدم أعلى لزوجـة من الماء بسبب وجود البروتینات والصفائح الدمویة العالقة فیه.
(5) الضغط
– بزیادة الضغط على السائل تزداد قوى التجاذب ب ین جزیئات السائل، وبالتالي تزداد اللزوجـة بعض الشيء .
(6) شكل الجزيء وتركیبه
كيفية قياس اللزوجة
– ھناك طریقتان للقیاس كما يلي:
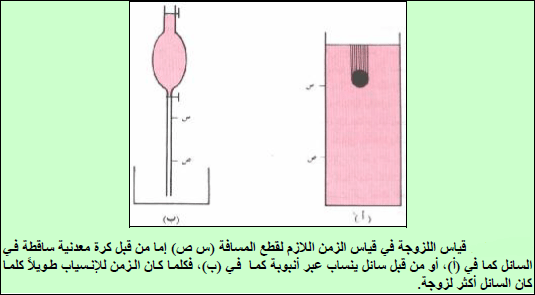
(1) تقاس عادة اللزوجـة بقیاس المسافة التي تقطعھا كرة حدیدیة خلال زمن معین في عمود من السائل ومنھا تقاس السرعة التي تتناسب عكسیاً مع اللزوجـة (شكل أ) .
(2) أو عبر قیاس المسافة التي یقطعھا السائل خلال زمن معین وذلك في عمود یحتوي على ھذا السائل (شكلب)، وھذه التجربة سنقوم بتطبیقھا في المعمل لتعیین اللزوجـة لبعض السوائل.
– استطاع العالم الفرنسي بوازیه Poisellieh الى التوصل لقانون لقياس اللزوجـة كما يلي:
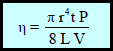
η: معامل (درجة) اللزوجـة وینطق (إیتا) ووحدتھا البواز (Poise)
r: نصف قطر الأنبوبة بوحدة (cm)
t: الزمن اللازم لتدفق السائل بوحدة الثانیة (sec)
P: الضغط الواقع على السائل.
L: طول الأنبوبة الشعریة بوحدة (cm)
V: حجم السائل المستخدم (بوحدة cm3)
الخلاصة
تعريف درجة اللزوجة (η)
– هي القوة بوحدة الداين (dyne) اللازمة لتحريك الوجه المنزلق من السائل بسرعة قدرها ((1 cm/sec
وحدة قياس اللزوجة
– هي البواز (Poise) وهي تعادل g/s.cm أو تكتب g s-1 cm-1
السيولة (f)
– مقلوب معامل اللزوجة یسمى السیولة (f): ηf = 1/
قياس اللزوجة النسبية
– تقاس اللزوجة عادة بما یسمى باللزوجة النسبیة وذلك بقیاس زمن سریان حجم معین من سائلین مختلفین خلال أنبوبة شعریة، ثم نقارن زمن سریانھا.
– ویمكن ایجادھا عملیاً باستخدام جھاز فیسكومیتر (استوالد) Ostwald Viscometer
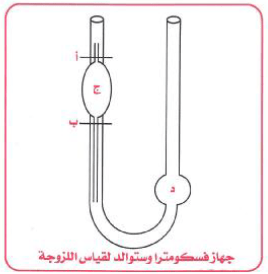
خطوات قياس اللزوجة النسبية لسائل باستخدام جهاز الفيسكومتر كما يلي:
(1) توضع كمیة مناسبة من السائل المراد ایجاد لزوجته في الإنتفاخ (د).
(2) یسحب السائل إلى الانتفاخ (ج).
(3) نحسب الزمن (t1) الذي يستغرقه السائل للسريان من العلامة (أ) إلى العلامة (ب).
(4) يغسل الجهاز ثم تعاد التجربة مع سائل آخر ونحسب الزمن (t2) له بنفس الخطوات السابقة.
(5) بمقارنة t1 مع t2 يمكن حساب معامل اللزوجة.
اشتقاق قانون معامل اللزوجة النسبية
– إذا كان لدینا سائلین مختلفین لھما نفس الحجم وكان معامل اللزوجة لھما (η1 , η2 ) وكان زمن تدفقهما (t1 , t2) فإن:
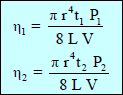
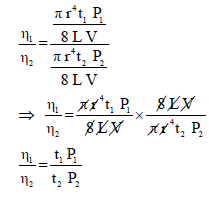
– وحیث أن الضغط یتناسب مع الكثافة (d)
حيث:η1 / η2: اللزوجـة النسبية ηrelative
η1: اللزوجـة المطلقة للسائل الأول
η2: اللزوجـة المطلقة للسائل الثاني
d1: كثافة السائل الأول
d2: كثافة السائل الثاني
t1 : زمن السائل الأول
t2 : زمن السائل الأول


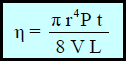
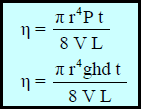

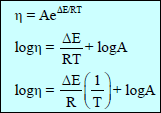
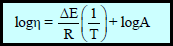
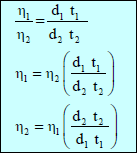





عندما نقوم بقياس اللزوجة لمحلول ما نسبة إلى الماء هل نضع الواحدة سنتي بواز أو بدون واحدة
عند زيادة الضغط يتناقص معامل اللزوجة ، لماذا يزداد؟
شكراً لجهودكم