الغليان ودرجة الغليان Boiling and Boiling Point

الغليان ودرجة الغليان Boiling Point
فعندما یكون ضغط البخار في ھذه الفقاعات منحفضاً، فإن ھذه الفقاعات لا تصمد طویلاً، وتنهار قبل أن تصل الى سطح السائل.
أما إذا كان ضغط البخار في ھذه الفقاعات مثل الضغط الجوي الواقع على سطح السائل، فإنھا تصعد الى سطح السائل وتتصاعد منھا جزیئات البخار في الھواء.
ملاحظات هامة
درجة الغلیان Boiling Point
تعريف درجة الغلیان t Boiling Poin
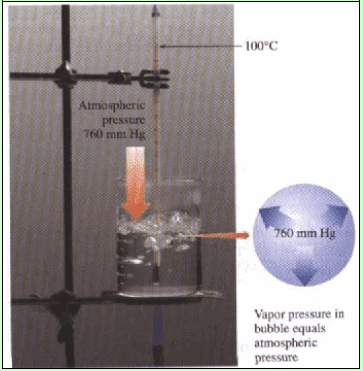
ھي درجة الحرارة التي یكون عندھا ضغط بخار السائل مساویاً للضغط الخارجي المؤثر على السائل.
ماذا یحدث لسائل عند تسخینه؟
إن تسخین سائل یقود باستمرار (بازدیاد درجة الحرارة) الى تفوق عملیة التبخر على عملیة التكثف. وعندھا تصل درجة الحرارة الى درجة الغلیان.
ویكون ھناك عدد من الجزیئات التي تمتلك القدر الكافي من الطاقة الحركیة الذي یمكنھا التغلب على قوى التجاذب ومن ثم التبخر.
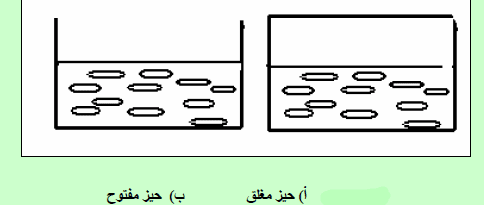
وعندئذ فإن السائل أثناء تحوله الى بخار عند ھذه الدرجة الحراریة یكون ذا ضغط بخاري یساوي ضغط النظام الخارجي المحیط به سواء كان ھذا النظام ھو الجو الخارجي المحیط به أو الحیز المغلق المحیط بالسائل، وفي ھذه الحالة سیمتد “مكان تحول جزیئات السائل الى بخار الى وسط السائل”. وسیشاھد عند ھذه الدرجة من الحرارة (درجة الغلیان) تكون فقاعات غازیة وسط السائل نفسه.
مشاھدة فقاعات وسط السائل عند غلیانه
ماذا یحدث لدرجة الغلیان عند ارتفاع أو انخفاض الضغط الخارجي؟
عند وجود ثلاث سوائل مختلفة في أنظمة مفتوحة تحت ضغط ثابت، ھل لها نفس درجة الغلیان .
درجة الغليان القياسية (النظامية أو الإعتيادية – العادية) Standard or Normal Boiling Point
العوامل المؤثرة على درجة الغليان
أولاً/ قوى التجاذب بین الجزیئات
أسئلة توضيحية
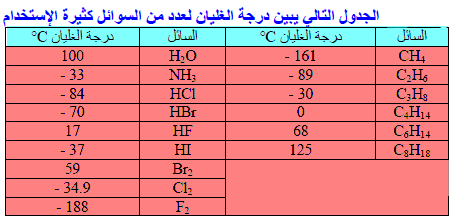
(1) درجة غليان الميثانول CH3OH أعلى من الميثان CH4؟
لأن الميثانول CH3OH قطبي ويحتوى بين جزيئاته على روابط هيدروجينية أما الميثان CH4 فهو غير قطبي ولا يحتوى على مثل هذه الروابط.
(2) درجة غليان الإيثانول C2H5OH أعلى من درجة غليان الإيثر الميثيلي CH3OCH3؟
لأن الإیثانول یوجد بین جزیئاته روابط ھیدروجینیة بعكس الإیثر المیثیلي الذي لا توجد بین جزیئاته مثل ھذه الروابط.
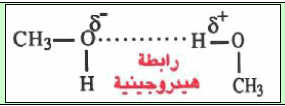
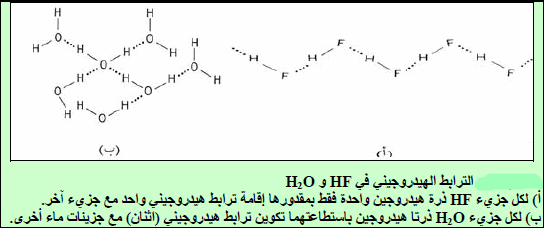
(3) درجة غليان الماء (H2O) أعلى من درجة غليان فلوريد الهيدروجين HF رغم كون HF أكثر قطبية من H2O؟
السبب ھو عدد الروابط الھیدروجینیة التي بإمكانھما تكوینھا. ففي HF كل جزيء مرتبطة برابطة ھیدروجینیة بجزیئین آخرین (شكل أ)، بینما في الماء، یمكن لكل جزيء أن یرتبط برابطة ھیدروجینیة بأربعة آخرین (شكل ب).
لذلك ورغم أن HF یكون روابط ھیدروجینیة أقوى نوعاً ما من الماء، إلا أن الشدة الإجمالیة للروابط الھیدروجینیة الأربعة لجزيء الماء تفوق الشدة الإجمالیة لرابطتي الهيدروجين لجزئ HF
ثانياً/ حجم الجزئ (الوزن الجزیئي)
ثالثاً/ الضغط الخارجي
– تزداد درجة الغلیان كلما زاد الضغط الخارجي، وتقل بانخفاضه.
– مثال: درجة غليان الماء عند سطح البحر (أي عند ضغط مقداره 1 atm) تساوي (100oC بينما درجة غليانه في الأماكن المنخفضة عن مستوى سطح البحر تزيد عن (100 oC) ، وفى الأماكن المرتفعة عن مستوى سطح البحر تقل درجة الغليان للماء عن (100 oC) وذلك بسبب انخفاض الضغط الخارجي.
– من التطبیقات لھذه العلاقة بین الضغط الخارجي ودرجة الغلیان أن صنعت أواني تعرف بأواني الضغط (مثل قدر الضغط وھو إناء محكم الغلق لطھي اللحم والخضار في درجة حرارة منخفضة جداً تصل إلى (40 oC)لنتجنب تكسیر الفیتامینات والمواد الأخرى المفیدة في درجة غلیان الماء والزیت العالیین)، علاوة على كسب الزمن للطھي السریع بھذه الطریقة (وفي ھذا القدر لا یسمح للبخار الموجود داخل جھازالضغط بالخروج فیزداد الضغط في الداخل فتزداد درجة الغلیان عن (100 oC) وھذا یساعد على زیادة سرعة الطھي.
الضغط البخاري ودرجة الغليان Vapour Pressure and Boiling Point
تجربة لإثبات غليان الماء عند درجة حرارة منخفضة عن 100 oC
التجربة
ھناك تجربة بسیطة توضح أن السائل یغلي عند درجة حرارة أقل تحت الضغوط المنخفضة وذلك:
(1) بأخذ كمیة من الماء في دورق·
(2) إضافة كمیة من النشادر إلیھا مع التسخین الى ما قبل الغلیان·
(3) ینكس في حوض به ماء ویصب فوق الدورق ماء بارد.
الملاحظة
يلاحظ أن الماء أخذ یغلي ، كما یلاحظ أن درجة الغلیان تزداد بازدیاد الوزن الجزیئي في السلاسل المتجانسة كنتیجة لازدیاد قوى فان درفالز.
كما أن درجة الغلیان تقل في المركبات ذات التركیب المتفرع أي في المركبات العضویة غیر المستقطبة.
وبشكل عام فإن درجة الغلیان تعبر عن قوة أو ضعف ارتباط الجزیئات مع بعضھا، فكلما كانت الجزیئات مرتبطة بقوة فإنه یلزم لتفكیكھا عن بعضھا طاقة عالیة، وبالتالي ترتفع درجة الغلیان والعكس صحیح.
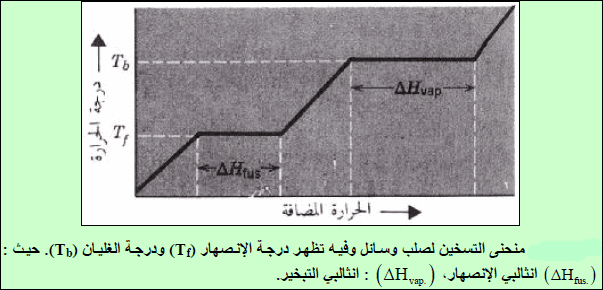
منحنى الغليان
صف ما یحدث لسائل عند تسخینه؟
عند تسخین سائل ترتفع درجة حرارته تدریجیاً (انظر الشكل ( أ – ب).
وھذه الزیادة تستمر الى الوصول الى الغلیان والتي عندھا فإن كامل الجزیئات اكتسبت القدر الكافي من الطاقة اللازم لتبخرھا، وعندئذ فإن الزیادة في الطاقة (مزید من الحرارة) لن یؤدي الى زیادة طاقة حركة جزیئات السائل وھذا سیؤدي الى:
(1) ثبوت درجة حرارة السائل.
(2) استھلاك كامل الطاقة المكتسبة لتحقیق غرض التبخر.
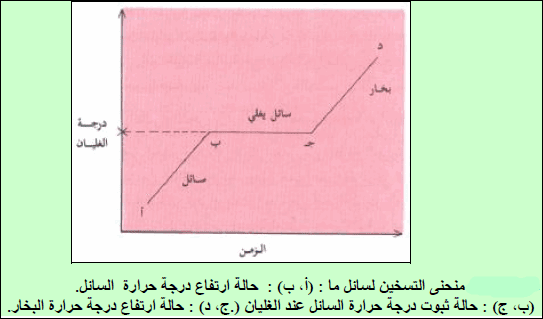
– ماذا سیحدث لدرجة الحرارة عند تبخر كل السائل؟
سترتفع من جدید كما یظھر من ( الشكل ( ج – د)
– ثبات درجة الحرارة عند الإنصھار لجامد ما ؟
– ثبات درجة الحرارة عند الغلیان لسائل ما ؟
وذلك نتیجة لكون الطاقة الحراریة المكتسبة تؤدي الى زیادة طاقة حركة الجزیئات
– ما علاقة درجة الغلیان وحرارة التبخر بقوى التجاذب بین جزیئات السائل؟
كلما ارتفعت درجة الغلیان كلما كان ھذا دلیلاً على قوى التجاذب بین جزیئات السائل.
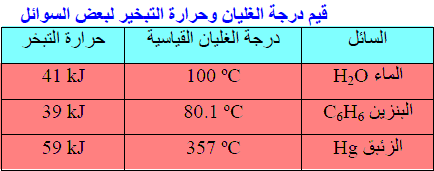
– ارتفاع درجة الغلیان القیاسیة وحرارة التبخیر للزئبق مقارنة بالماء والبنزین
كما في الجدول التالي:
وذلك بسبب أن الزئبق یكون روابط معدنیة – فلزیة بین ذراته وھي أقوى من الروابط الھیدروجینیة التي یكونھا الماء بین جزیئاته. أما البنزین C6H6 فهو غير قطبي.