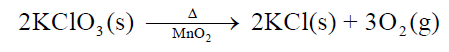تجميع الغازات فوق سطح الماء
– فى هذا الموضوع سيتم مناقشة كيفية تجميع الغازات فوق سطح الماء Collecting Gases Over Water مع التوضيح عملياً بمثال فعلي.
محتويات الموضوع
كيفية تجميع الغازات فوق سطح الماء
– من التطبيقات العملية لقانون دالتون للضغوط الجزئية حساب ضغوط الغازات المتجمعة فوق سائل.
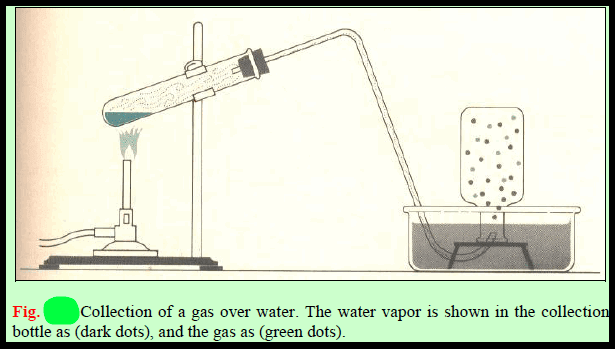
– وكثیراً ما يتم تجميع الغازات المحضرة في المختبر عن طریق إزاحة الماء.
– إذا تم تجميع الغازات فوق سطح سائل متطاير مثل الماء فیجب إجراء تصحيح لضغطه نظراً لكمیة بخار الماء الموجودة مع الغاز (یكون الغاز الذي یجمع بھذه الطریقة ملوثاً بجزیئات الماء التي تتبخر الى داخل الغاز).
– ویكون الغاز المتجمع فوق الماء مشبعاً ببخار الماء الذي یشغل الحجم للغاز وله ضغط جزئي.
– الضغط الجزئي لبخار الماء Vapor pressure محدد عند كل درجة حرارة ولا یعتمد على طبیعة الغاز أو ضغطه.
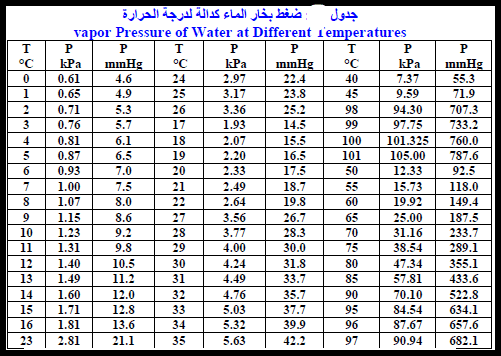
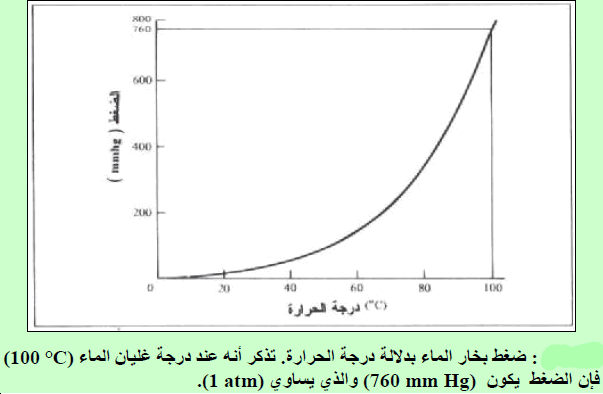
– ھذه القیمة المحددة لضغط بخار الماء – كدالة في درجات الحرارة – موجودة في جداول بالمراجع العلمیة.
– جدول يوضح ضغط بخار الماء كدالة لدرجة الحرارة Vapor Pressure of Water at Different Temperatures كما يلي:
– منحنى تغیر ضغط بخار الماء مع درجة الحرارة يظهر كما بالشكل التالي:
– ویساھم ضغط بخار الماء في الضغط الكلي للغاز الرطب.
– وحسب قانون دالتون للضغوط الجزئیة فإن:
– إذا جمع الغاز فوق سطح الزئبق فلیس من الضروري إجراء تصحیحات لضغط بخار الزئبق لأن ضغط بخار الزئبق یعتبر كمیة مھملة عند درجات الحرارة العادیة.
– ونلاحظ أن مستوى الماء واحداً داخل دورق التجمیع وخارجه، لذلك فإن الضغط في الداخل یجب أن یكون مساویاً للضغط في الخارج (أي یساوي الضغط الجوي).
– والضغط الجوي یمكن قیاسه بواسطة جھاز البارومتر. أما ضغط بخار الماء یمكن الحصول علیه من الجدول أعلاه إذا عرفنا درجة الحرارة، وبالتالي فإنه یمكن لحساب الضغط الجزئي للغاز النقي كما يلي:
Pgas = Pt – PH2O
مثال توضيحي لتجميـع الغازات فوق سطح الماء
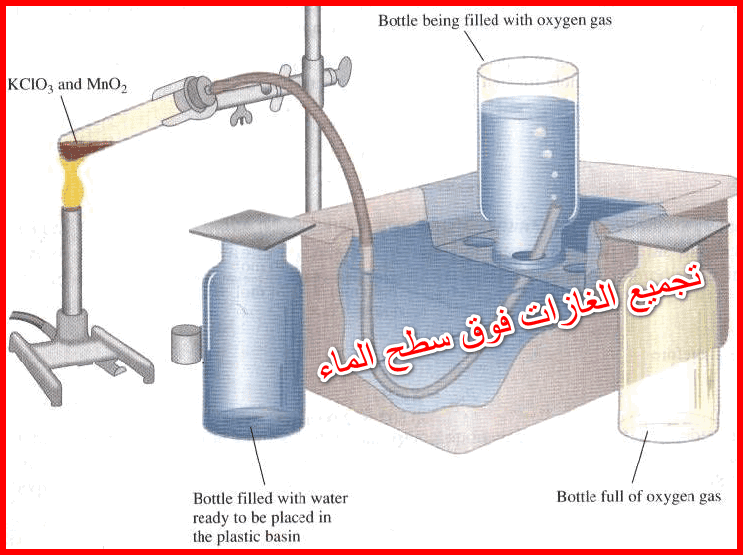
– مثال: تجميع غاز الأكسجين فوق سطح الماء
– یحضر الأكسجين بتسخین كلورات البوتاسیوم KClO3 كما يلي:
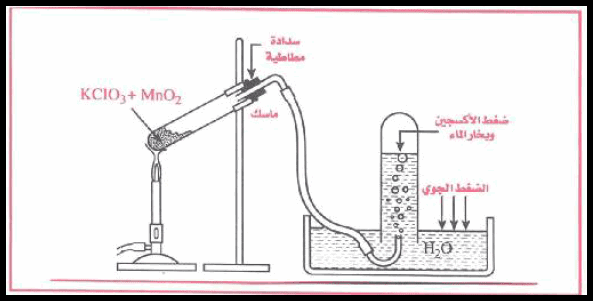
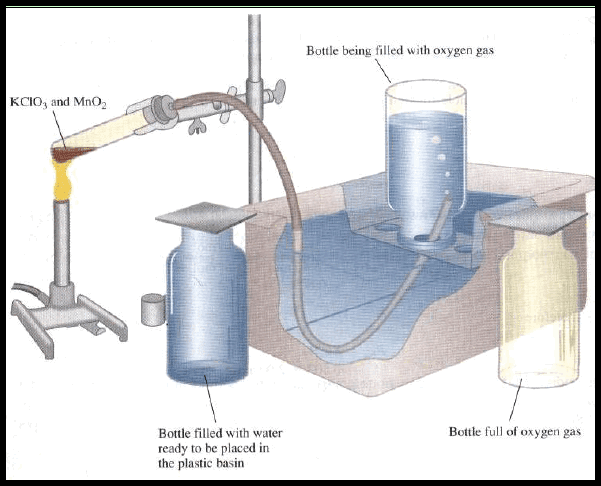
– وعندما ینتج الأكسجین یجمع فوق الماء كما بالشكلين الآتيين:
– ولكن غاز الأكسجين الذي جمع بھذه الطریقة لا یعتبر نقیاً، وذلك لوجود بخار الماء في نفس الحیز.
– ولهذا فإن الضغط الكلي Pt للغاز الموجود فوق الماء يساوي مجموع الضغط الناتج عن غاز الأكسجين PO2 وعن غاز بخار الماء PH2O كما يلي:
Pt = PO2 + PH2O
PO2 = Pt – PH2O