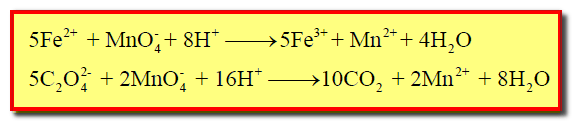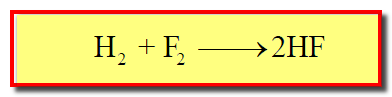أثر طبيعة المواد المتفاعلة على معدل سرعة التفاعل الكيميائي
– في هذا الموضوع سيتم مناقشة لماذا تعتبر طبيعة المواد المتفاعلة أحدى العوامل المؤثرة على سرعة التفاعل الكيميائي مع الأمثلة والتمارين التوضيحية.
محتويات الموضوع
اعتماد سرعة التفاعل على طبيعة المواد المتفاعلة
Dependence of Reaction Rate on Nature of Reactants
– من البديھي أن السرعة التي تحدث فيها التفاعلات المختلفة عند نفس الظروف الفيزيائية تختلف من تفاعل إلى آخر حسب المواد الداخلة في التفاعل والناتجة عنه. وھذا ناتج عن طبيعة كل مادة أو عنصر كيميائي داخل أو ناتج عن التفاعل.
– حيث تؤثر طبيعة المواد المتفاعلة (الصفات الكيميائية والحالات الفيزيائية للمواد المتفاعلة) تأثيراً مباشراً وفعالاً في سرعة التفاعل الكيميائي.
ما المقصود بطبيعة المواد المتفاعلة؟
– يقصد بطبيعة المواد المتفاعلة اختلاف الخواص الفيزيائية والكيميائية للمواد المتفاعلة فمثلاً:
- اختلاف عدد ونوع الروابط بين الذرات الموجودة فى المواد المتفاعلة.
- اختلاف عدد ونوع الذرات المكونة للمواد المتفاعلة.
- اختلاف حالة المواد المتفاعلة من حيث كونها صلبة، سائلة أو غازية. بالإضافة إلى كونها مشحونة أو غير مشحونة.
– كما تعتمد قابلية المواد الكيميائية للتفاعل على نشاطها الكيميائي، وهذا النشاط محكوم بقابليتها لتكوين روابط كيميائية، العامل الكبير الذي يحدد سرعة التفاعل.
أمثلة توضيحية لأثر طبيعة المواد على سرعة التفاعل
– لو كان لدينا ثلاث قطع من معادن الصوديوم (Na) والخارصين (Zn) والقصدير (Sn) لها نفس الحجم والشكل ووضعنا كل قطعة فى محلول من حمض كلوريد الهيدروجين (HCl) له نفس التركيز فإننا نجد أن:
- قطعة الصوديوم تتفاعل بشدة.
- أما قطعة الزنك فسوف يكون تفاعلھا بمعدل أقل.
- وبالنسبة لقطعة القصدير فإنھا سوف تتفاعل ببطء شديد جداً.
خواص المواد المتفاعلة المؤثرة على معدل سرعة التفاعل الكيميائي
(1) الحالة الفيزيائية للمواد المتفاعلة
– الحالة الفيزيائية للمادة مهمة جداً لتحديد فعاليتها ، فالفسفور الأبيض والفوسفور الأحمر يمثلان شكلين مختلفين من عنصر الفسفور فى الحالة الصلبة، ولكنهما يختلفان فى الفعالية عندما يتعرضان للھواء الجوي.
– فالفسفور الأبيض يتوھج بمجرد تعرضه للأكسجين في الھواء الجوي.
– أما الفسفور الأحمر فعلى العكس من ذلك حيث يمكن يبقى معرضاً للهواء لمدة طويلة من الزمن دون أن يتوهج.
(2) سهولة وصعوبة فقد الكترونات التكافؤ
– صدأ الحديد يحدث نتيجة لتفاعل الحديد مع أكسجين الهواء وبخار الماء ، وهذا التفاعل بطئ وذلك لأن الحديد لا يفقد إلكترونات تكافؤه بسھولة.
– تعريض الصوديوم للهواء يؤدي إلى تكون طبقة من الأكسيد بسرعة وھذا نتيجة لتفاعل الصوديوم مع الأكسجين وبخار الماء الذي في الھواء ويفقد الصوديوم لإلكترون تكافئه بسرعة.
(3) نوع الروابط فى المواد المتفاعلة
– علاوة على ذلك وجد أن المركبات ذات الرباط الأيوني (المركبات الأيونية) مثل كلوريد الصوديوم (NaCl) تتفاعل بسرعة أكبر مقارنةً بالمواد ذات الرباط التساھمي (المركبات التساھمية).
(4) تشابه التركيب الكيميائي للمواد المتفاعلة
– المواد ذات التركيب الكيميائي المتشابه تتفاعل مع بعضھا بسرعة أكبر مما لو كانت هذه المواد ذات تركيب كيميائي متباين (مختلف).
– أيونات الحديد الثنائي تتفاعل مع البرمنجنات بشكل أسرع من تفاعل الأوكسالات مع البرمنجنات كما بالمعادلة الآتية:
– وسبب ذلك اختلاف طبيعة أيونات الحديد عن أيونات الأوكسالات حيث يتطلب فى الأوكسالات كسر روابط تساهمية.
(5) النشاط الكيميائي
– علاوة على ذلك فأن اختلاف الخواص الكيميائية للمواد المتفاعلة يؤثر على سرعة التفاعل.
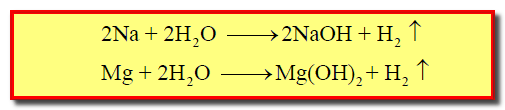
– الصوديوم يتفاعل مع الماء بشكل أقوى وأسرع من المغنسيوم كما بالمعادلات الآتية:
– وسبب ذلك اختلاف طبيعة الصوديوم عن المغنسيوم ، حيث أن الصوديوم أكثر نشاطاً من المغنسيوم.
(6) تغيير الحالة الفيزيائية للمتفاعلات
– بعض المواد لا تتفاعل عندما تكون فى الحالة الصلبة، ولكن عندما تكون على شكل محلول فإنھا تتفاعل.
– عند خلط كمية صلبة وجافة من كبريتات البوتاسيوم الصلب مع كمية صلبة وجافة من نترات الباريوم فإنهما لا يتفاعلان حتى ولو بقيا مدة طويلة من الزمن.
– ولكن إذا خلطنا المادتين وهما على شكل محاليل بتراكيز معينة فإنهما يتفاعلان بسرعة. ويتكون راسب ابيض من كبريتات الباريوم كما يلي:
– يتفاعل الهيدروجين مع الفلور بشدة تصل إلى حد الانفجار في درجة الحرارة العادية (تفاعل سريع جداً فى درجة حرارة الغرفة) كما بالمعادلة الآتية:
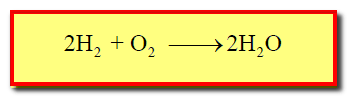
– يتفاعل الهيدروجين والأكسجين يتفاعلان ببطء في درجات الحرارة العادية (تفاعل بطئ جداً فى درجة حرارة الغرفة) كما بالمعادلة الآتية:
– بالإضافة إلى ذلك فأن بالنيكل والحديد يتآكلان فى الهواء بدرجات مختلفة فبينما يتآكل الحديد بسرعة فى الهواء ويتآكل النيكل ببطء شديد.
– يتفاعل الصوديوم بشدة مع الماء في درجة الحرارة، في حين يتفاعل ببطء مع الكحول الإيثيلي وكذلك مع الكحول الميثيلي.
– تعتبر جميع التفاعلات السابقة تفاعلات تلقائية ولها طاقة حرة سالبة (- = ΔG)
(7) طاقة تحطم الروابط
– وينشأ الاختلاف في مدى نشاط – التفاعلات السابقة – من اختلاف بينة ذرات وجزئيات المواد المتفاعلة، فإذا حدث التفاعل بين نوعين مختلفين من الجزئيات وترتبط ذراتها بروابط تساهمية وقوية فإن تصادمها عند درجات الحرارة العادية لا يصاحبه طاقة كافية لتحطم تلك الروابط.
– تفاعل الهيدروجين مع الأكسجين لإعطاء الماء يحتاج إلى طاقة 436kJ/mol لتتحطم رابطة (H-H) وكذلك طاقة تبلغ 498.3kJ/mol لتتحطم رابطة (O – O) وهي قيم عالية تبين قوة الروابط التساهمية فى كليهما.
– وفى المقابل نجد أن طاقة تحطم رابطة الفلور التساهمية (F-F) منخفضة إذ تبلغ 157kJ/mol (أقل من ثلث طاقة تحطم O- O).
– يبرز الفارق الكبير فى طاقة تحطم الروابط شدة تفاعل الهيدروجين والفلور فى الدرجات العادية، بينما يحتاج تفاعل الهيدروجين والفلور فى الدرجات العادية، بينما يحتاج تفاعل الأكسجين والهيدروجين إلى درجات عالية لإحداث التفاعل.
ملخص تأثير طبيعة المواد المتفاعلة على معدل سرعة التفاعل الكيميائي
– نستخلص مما سبق المعلومات الهامة الآتية كما يلي:
(1) تفاعل الأيونات اسرع من الذرات.
(2) تفاعل الذرات أسرع من الجزيئات.
(3) تفاعل الجزيئات قليلة الروابط أسرع من الجزيئات كثيرة الروابط.
(4) تفاعل الأيونات قليلة الروابط اسرع من الأيونات كثيرة الروابط.
أسئلة محلولة على طبيعة المواد المتفاعلة على معدل سرعة التفاعل الكيميائي
– هذه بعض الأسئلة التى توضح تأثير طبيعة المتفاعلات على سرعة التفاعل الكيميائي كما يلي:
مواضيع متعلقة: (أضغط على الموضوع الذي تريده)
(1) سرعة التفاعل الكيميائي وطرق قياسها والعوامل المؤثرة عليها
(2) أثر درجة الحرارة على سرعة التفاعل الكيميائي
(3) أثر طبيعة المواد المتفاعلة على سرعة التفاعل الكيميائي
المراجع : الفصل الأول ” التفاعل الكيميائي والعوامل المؤثرة عليه ” من كتاب الكيمياء الحركية kinetic chemistry للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء – كلية العلوم التطبيقية – جامعة أم القرى.