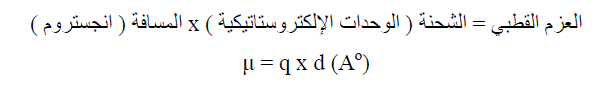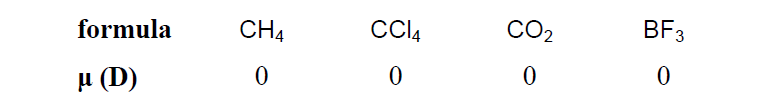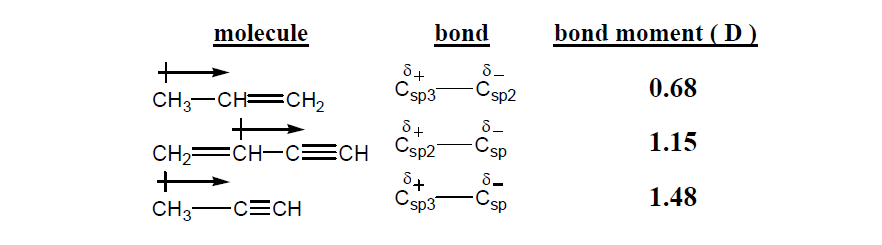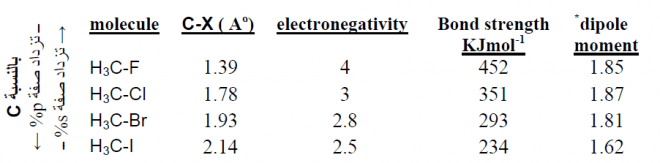العزم القطبي Dipole moment
– فى هذا الموضوع سيتم مناقشة العزم القطبي Dipole moment وكيفية حساب العزم القطبى مع الأمثلة والتمارين للتوضيح.
محتويات الموضوع
تعريف العزم القطبي Dipole moment
– العزم القطبي Dipole moment هو الخاصية التي يمكن قياسها من توزيع الشحنة الكهربية لجزئ ما من خلال قياس مدى عدم انطباق مركز التوزيع الإلكتروني في الجزئ على مركز توزيع الشحنة النووية الموجبة.
– ويتم حساب قيمة العزم القطبى من العلاقة الآتية كما يلي:
– علاوة على ذلك يقدر العزم القطبى بوحدة تسمى Debye نسبة للعالم Peter J.W. Debye
– ويرمز لها بالرمز (D) وتساوي في النظام العالمي SI كما يلي:
تعريف عزم الرابطة
– عزم الرابطة هو العزم القطبي لرابطة مفردة.
– إذا كان الجزئ يتكون من ذرتين فأن عزم الرابطة = عزم ثنائي القطب.
– إذا كان الجزئ يتكون من عدة ذرات فأن عزم الرابطة = محصلة متجهات عزم الروابط المختلفة للجزئ.
– حيث تعتمد قطبية الجزئيات على فارق السالبية الكهربية لذرات العناصر وعلى الشكل الهندسي للجزئ وكذلك وضع الأزواج الإلكترونية غير الرابطة.
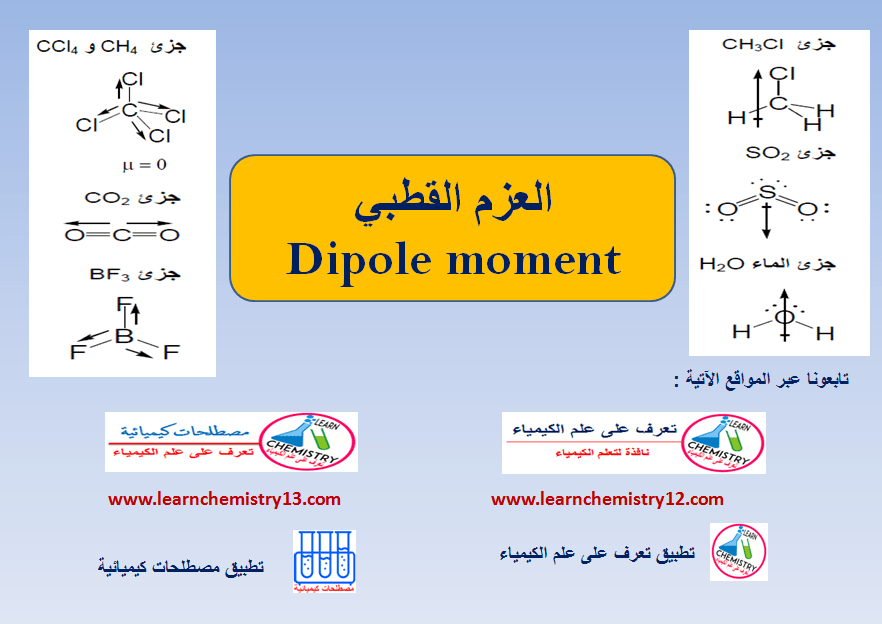
العزم القطبي للجزيئات غير القطبية Nonpolar molecules
– الجدول التالي يوضح العزم القطبى لبعض الجزيئات غير القطبية كما يلي:
العزم القطبي للجزيئات القطبية Polar Molecules
– الجدول التالي يوضح العزم القطبى لبعض الجزيئات القطبية كما يلي:
ملاحظات هامة
– تساهم الأزواج الإلكترونية غير الرابطة بشكل كبير في العزم القطبي للماء و الأمونيا وذلك لأنها لا تتصل بذرة أخري لتعادل جزءً من شحنتها السالبة وبالتالي تساهم بعزم كبير بعيداً عن الذرة المركزية.
– تؤثر قيم الكهروسالبية لذرات العناصر تأثير واضح على العزم القطبى وكذلك على قيم عزم الرابطة C-C الأحادية إعتماداً على التهجين.
– والقيم التالية قام بإحتسابها العالم بيترو Petro سنة 1985 م كما يلي:
– يتضح من هذه القيم أنه كلما زاد الفارق في الكهروسالبية زاد عزم الرابطة كما يلي:
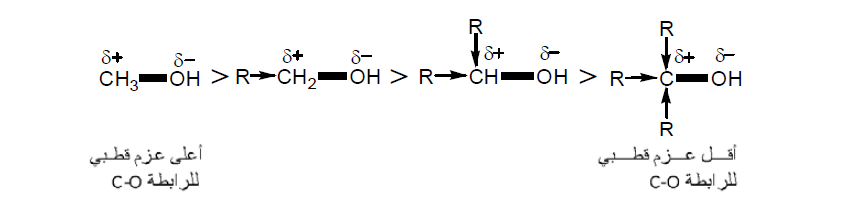
– تعمل المجموعات الدافعة للإلكترونات علي إنقاص العزم القطبى للرابطة حيث تصبح الشحنة منتشرة وغير متمركزة ، والعكس صحيح بالنسبة للمجموعات الساحبة للإلكترونات كما يلي:
أسئلة محلولة على العزم القطبي
سؤال (1):
إن قيمة العزم القطبي للمركب HC≡C-CH2-CH2 هو 0.8D أكبر بكثير من قيمة العزم القطبى للمركب H2C=CH-CH2CH3 والتي تبلغ 0.3D.
فكيف تفسر هذا الأختلاف على الرغم من أنهما ناتجان بصورة رئيسية عن قطبية واحدة من روابط C-C الأحادية في الجزيئين؟
الجواب:
– تفسير ذلك هو أن الرابطة في المركب الأول ناتجة من تهجين Csp -Csp3 فتكون أعلى سالبية من الرابطة في المركب الثاني الناتجة من تهجين Csp2 -Csp3 ( أنظر إلى الجدول رقم 1).
سؤال (2):
العزم القطبي للمركب CH3Cl هو 1.87D أكبر من العزم القطبى للمركب CH3F هو 1.85D رغم أن كهروسالبية الفلور أعلى من كهروسالبية الكلور. فسر ذلك؟
الجواب:
– السبب في ذلك هو صغر حجم ذرة الفلور الذي يؤدي إلى قربها من ذرة الكربون فيقل العزم القطبى.
المراجع : الفصل الأول ” الترابط وخواص الجزيئات ” من كتاب أسس الكيمياء العضوية. Foundations of Organic Chemistry للمؤلفين وائل غالب محمد – وليد محمد السعيطي