الرابطة الفلزية والخصائص الفيزيائية للفلزات
قبل أن نتكلم عن الخواص الفيزيائية للفلزات لابد أولاً من التعرف على الرابطة الفلزية Metallic bonding حيث يرجع السبب في تمتع الفلزات بالكثير من الخصائص الرائعة والمميزة إلى وجود تلك الرابطة.
محتويات الموضوع
تعريف الرابطة الفلزية Metallic bonding
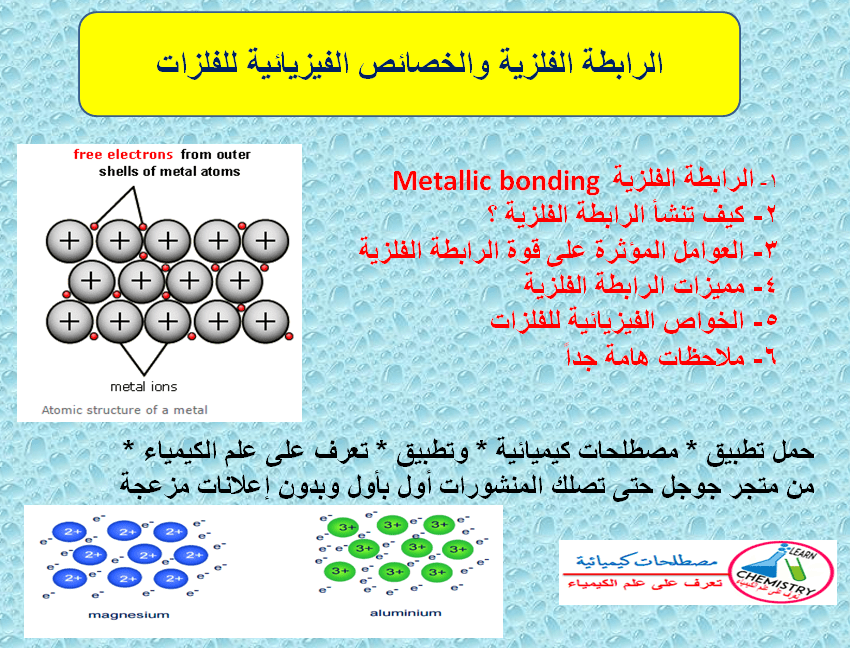
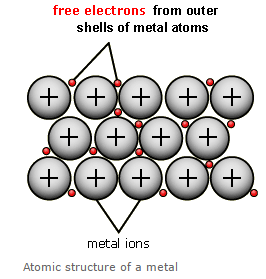
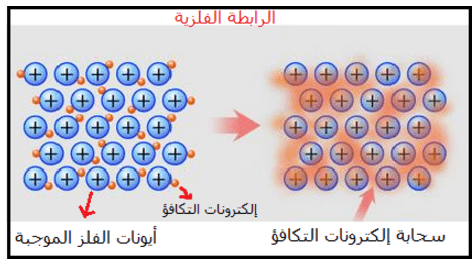
– الرابطة الفلزية هي قوة التجاذب بين الأيونات الموجبة للفلزات والالكترونات الحرة في الشبكة البلورية.
– أو أن الرابطة الفلزية هي رابطة تنشأ من سحابة الكترونات التكافؤ الحرة التي تقلل من قوى التنافر بين أيونات الفلز الموجبة في الشبكة البلورية .
– الإلكترونات الحرة delocalised electrons هي الإلكترونات التي تكون الرابطة الفلزية وتتحرك من ذرة إلي ذرة أخري في الفلز ولا تكون منجذبة إلى ذرة بعينها لذلك تسمى هذه الالكترونات بالحرة.
كيف تنشأ الرابطة الفلزية؟
– عندما تكون ذرات الفلز قريبة من بعضها في الحالة الصلبة ، فأن كل ذرة فلز تميل لفقد إلكترون أو أكثر من إلكترونات التكافؤ في الغلاف الخارجي.
– لكن تمتاز هذه الالكترونات بأنها حرة الحركة في بلورة الفلز.
– مما يؤدي إلى تخلل إلكترونات التكافؤ (التى تكون على شكل سحابة) بين الأيونات الموجبة للفلز.
– تقوم هذه السحابة بتقليل قوى التنافر بين أيونات الفلز فتربطها معاً وتتكون الرابطة الفلزية في نموذج يدعى البحر الالكتروني The sea of electrons
العوامل المؤثرة على قوة الرابطة الفلزية
(1) عدد الإلكترونات الحرة
– بزيادة عدد الإلكترونات الحرة الغير متمركزة تزداد قوة الجذب تزداد قوة الجذب بين الأيونات الموجبة والإلكترونات الحرة مما يزيد قو الرابطة الفلزية.
(2) شحنة الكاتيون أو عدد البروتونات الموجبة
– كلما زاد عدد البروتونات فى ذرة الفلز كلما زادت قوة الجذب بين الأيونات الموجبة والإلكترونات الحرة مما يزيد قو الرابطـة الفلزية.
(3) حجم ذرة الفلز
– كلما قل حجم ذرة الفلز كلما زادت قوة الجذب بين الأيونات الموجبة والإلكترونات الحرة مما يزيد قو الرابطة الفلزية.
مميزات الرابطة الفلزية
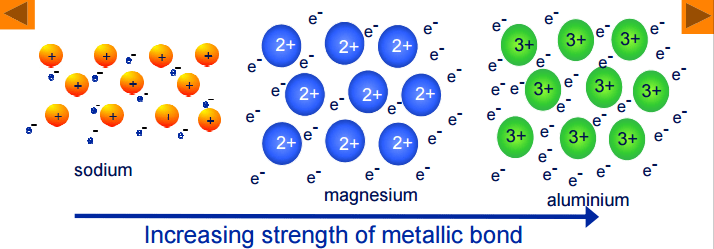
كلما زاد عدد الكترونات التكافؤ في ذرة الفلز يحدث الآتي :
(1) تزداد قوة الرابطة الفلزية
(2) تصبح الذرة أكثر تماسكاً وصلابة
(3) تزداد درجة انصهار الفلز
– فمثلاً نجد أن درجة انصهار الألومنيوم أعلى من درجة انصهار الصوديوم وذلك لأن إلكترونات التكافؤ للألومنيوم (3) أكثر من إلكترونات التكافؤ للصوديوم (1).
– وبالتالي تكون السحابة الالكترونية التي تربط بين أيونات الألومنيوم أكبر من السحابة الالكترونية التي تربط بين أيونات الصوديوم.
– وبالتالي تزداد قوة الرابطة الفلزية في الألومنيوم عنها في الصوديوم مما يزيد من درجة انصهاره.
الخواص الفيزيائية للفلزات
- معظمها مواد صلبة
- درجات انصهارها وغليانها مرتفعة
- لها بريق ولمعان
- موصلات جيدة للحرارة والكهرباء
- قابلة للطرق والسحب
ملاحظات هامة على الخواص الفيزيائية للفلزات
(1) تختلف درجات انصهار الفلزات على نحو كبير
– حيث نجد الزئبق سائل عند درجة حرارة الغرفة على العكس تصل درجة انصهار التنجستن إلى 3422 سلزيوس.
(2) درجة انصهار الفلزات ليست مرتفعة جداً كدرجات غليانها
– لأنه في عمليات الانصهار فأن الأيونات الموجبة والالكترونات الحرة الحركة في الفلز ليست بحاجة إلى طاقة كبيرة جداً لجعلها تتحرك فوق بعضها البعض.
– أما في عملية الغليان يجب فصل الذرات عن مجموعة الأيونات الموجبة والإلكترونات الحرة الأخرى مما يتطلب طاقة كبيرة جداً.
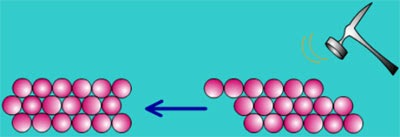
(3) الفلزات قابل للطرق والسحب
– تؤدى القوة المؤثرة الخارجية إلى جعل الأيونات تتحرك عبر الالكترونات الحرة مما يجعل الفلز قابلاً للطرق والسحب.
– ويعني مصطلح (قابلة للطرق) أنها تتحول إلى صفائح عند طرقها ، و (قابلة للسحب) أنها يمكن تحويلها إلى أسلاك.
(4) تأثير الطرق على كلاً الفلزات والمركبات الأيونية بالمطرقة
– في المركبات الأيونية: إذا كانت القوة المؤثرة كبيرة بقدر كاف فإنها تحرك الأيونات من إمكانها وتؤدى قوة التنافر بين الأيونات ذات الشحنات المتشابهة إلى كسر البلورة.
– أما فى الفلزات تؤدى القوة المؤثرة الخارجية إلى جعل الأيونات تتحرك عبر الالكترونات الحرة مما يجعل الفلز قابلاً للطرق والسحب وقد يتغير شكل الفلز ولكنه لا يتحطم.
(5) الفلزات توصل الحرارة والكهرباء
– وذلك نتيجة لحركة الالكترونات الحرة بحرية حول أيونات الفلز الموجبة.
(6) تتميز الفلزات بأن لها بريق ولمعان
– وذلك بسبب تفاعل الالكترونات الحرة مع الضوء عن طريق الامتصاص ثم إطلاق الفوتونات.
إقرأ ايضاً : مقدمة عن الفلزات