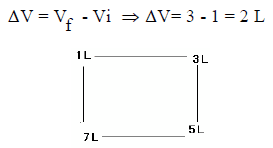حالة النظام الثيرموديناميكي ودالة الحالة
– في هذا الموضوع سيتم مناقشة حالة النظام الثيرموديناميكي ودالة الحالة State of the System and State Functions
محتويات الموضوع
حالة النظام الثيرموديناميكي
– الحالة في علم الثیرمودینامیك تعني الكمیات التي یمكن قیاسھا (المتغیرات الثیرمودینامیكیة) أو توابع الحالة (مثل الحجم والضغط ودرجة الحرارة والمكونات).
– وقد سمیت بذلك لأنھا تساھم في تحدید الحالة الفیزیائیة لنظام معین.
– وقیمتھا في أي حالة من الحالات لا تعتمد على تاریخ العینة السابقة.
– فعلى سبیل المثال : لا یعتمد حجم مول واحد من الماء عند 25 Co وضغط (1 atm) على قیم درجة حرارته أو ضغطه في فترة زمنیة سابقة.
– بالإضافة إلى ذلك أنه حین ننتقل من حالة الى أخرى فإن التغییرات في قیم (T, V, P) لا تعتمد على كیفیة معالجة العینة.
– فإذا تم تغییر درجة الحرارة لعینة من الماء 25 Co إلي 35 Co فلا فرق فیما إذا تم تبرید العینة الى 0 Co ومن ثم تسخینھا الى 25 Co أو تم تسخینھا مباشرة من 25 Co إلى 35 Co فدرجة الحرارة في الحالة النھائیة ھي نفسھا بغض النظر عن الطریق التي سلكت بین الظرفین (الحالتین) الأولي والنھائي.
– ولذلك فإن التغییر في درجة الحرارة ((ΔT یعتمد فقط على درجتي حرارة الحالتین الأولیة والنھائیة.
– إذا كان لدینا نظام غازي متجانس (homogeneous) يتكون من مادة واحدة فإن مكوناته بالطبع ثابتة ومن ثم فإن حالة النظام تعتمد على الضغط والحجم ودرجة الحرارة فقط.
– وإذا كانت جمیع ھذه الكمیات ثابتة فإن جمیع الخواص الفیزیائیة الأخرى مثل الكتلة والكثافة واللزوجة (viscosity) …….. یجب أن تكون ثابتة.
معادلات الحالة State Equation
– ھناك بعض الأمثلة التي یمكن التعبیر فیھا عن العلاقات البینیة بین دالات الحالة (T, V, P) بواسطة معادلة تسمى معادلة الحالة equation of state
– وبالتالي فمعادلة الحالة ھي علاقات ریاضیة لحساب المتغیرات الثیرمودینامیكیة(T, V, P)
– معادلة الحالة للغاز المثالي حیث تكون فیه العلاقة بین الضغط والحجم وكمیة الغاز ودرجة الحرارة كما یلي:
PV = nRT
وھي معادلة الحالة للغاز المثالي حیث :
P= الضغط (atm) ، V= الحجم (L) ، n= عدد المولات ، T= درجة الحرارة المطلقة (K)
R= ثابت الغازات العام (0.0821 L.atm/ mol.K)
– ملحوظة: مقدار التغیر في توابع الحالة لا یعتمد على المسار الذي یسلكه النظام عندما یتغیر من حالة الى أخرى وإنما یعتمد على الحالة الإبتدائیة والنھائیة للنظام
مثال توضيحي
الحجم الابتدائي لغاز (Vi = 1 L) ثم يتمدد ليصبح (Vf = 3 L) فإن التغير يساوي كما يلي:
الحجم النھائي ھو (3 L)بغض النظر عن الطریقة التي اتبعت لإحداث ھذا التغیر.
– تم الإتفاق على أن تكون رموز توابع الحالة بحروف كبیرة مثل: الإنثالبي (H) ، الطاقة الداخلية (U) ، الأنتروبي (S) ، الطاقة الحرة (G)
تعريف دالة الحالة Function of State
– دالة الحالة هي تلك الخاصية أو الكمية التي تعتمد فقط على الحالة الأبيتدائية قبل التغير ، والحالة النھائیة بعد التغیر، بغض النظر عن الطریق أو المسار الذي تم من خلاله التغیر.
– ومن أمثلتها: الإنثالبي (H) ، الطاقة الداخلية (U) ، الأنتروبي (S) ، الطاقة الحرة (G)
– أما الكنيات (q) ، (W) (كمیة الحرارة والشغل) فإن قیمتھا تتغیر كثیراً بتغیر ظروف التجربة، وبالتالي فھي لا تعتبر “دالة حالة أو تابع حالة” حیث أنھا تعتمد على المسار والخطوات التي تم من خلالھا التغیر، ولا تعتمد على الحالة الإبتدائیة والحالة النھائیة فقط.
خواص النظام الثيرموديناميكي الفيزيائية
– سوف نتكلم هنا عن الخواص الماكروسكوبية والميكروسكوبية Macroscopic and Microscopic Properties للنظام الثيرموديناميكي.
– حيث تعتمد الخواص الماكروسكوبیة للنظام على التركیب الخارجي لمحتویات النظام.
– بینما تعتمد الخواص المیكروسكوبیة على التركیب الداخلي للذرات والجزیئات المكونة للنظام.
الخواص الماكروسكوبية Macroscopic Properties
– وتقسم الخواص الماكروسكوبیة الى قسمین وھما كما يلي:
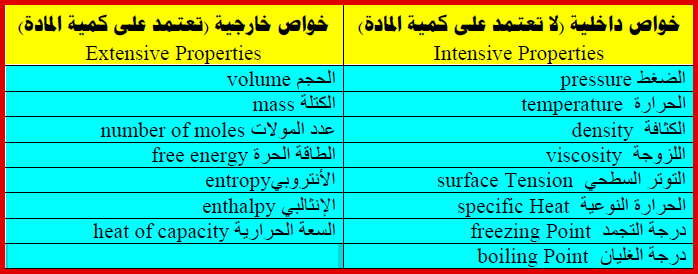
(أ) خواص شاملة (Extensive Properties) (خواص انتشارية) (خواص خارجية)
– وھي تشمل جمیع الخواص التي تعتمد على كمیة المادة أو المواد الموجودة في النظام
– مثل: (الكتلة، الحجم، السعة الحراریة، الطاقة الداخلیة، الأنتروبي، الطاقة الحرة، مساحة السطح، …) وكلھا خواص تعتمد على مقدار المادة الموجودة في النظام.
(ب) خواص مركزة (Intensive Properties) (خواص مستقلة) (خواص داخلية)
– وتشمل جمیع الخواص التي لا تعتمد على كمیة المادة الموجودة في النظام
– مثل: (الضغط، درجة الحرارة، الكثافة، اللزوجة، الحرارة النوعیة، التوتر السطحي).
– الجدول التالي يوضح بعض الخواص الشاملة والمركزة كما يلي:
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية