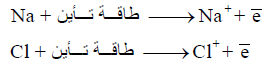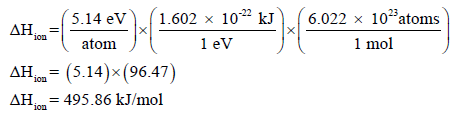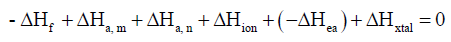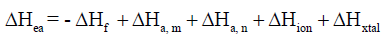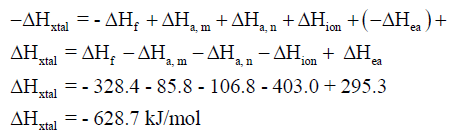إنثالبي التأين – إنثالبي الألفة الإلكترونية – إنثالبي البلورات الأيونية
– في هذا الموضوع سيتم مناقشة إنثالبي التأين – إنثالبي الألفة الإلكترونية – إنثالبي البلورات الأيونية – وشرح دورة بورن -هابر بالتفصيل.
محتويات الموضوع
إنثالبي التأين Ionization enthalpy
– تحتاج الذرة الى طاقة معینة للتخلص من الكترون كما نرى في المثالين التالیین:
– تحسب طاقة التأین ΔHion بوحدة eV (الكترون فولت) ولتحويلها إلى وحدة kJ فإن :
1eV = 1.602 x 10-22 kJ
– فإذا بلغت طاقة تأین ذرة صودیوم واحدة (5.14 eV) فإن انثالبي التأین لمول من ذرات الصوديوم یكون:
– يتضح من إشارة ΔHion أن لذرة تحتاج لامتصاص ھذا القدر من الطاقة لتأین مول واحد منھا.
– وقد اتفق على استخدام المعامل وذلك لتحویل الوحدات من إلكترون فولت بالذرة الى كیلو جول بالمول ذرة.
إنثالبي الألفة الإلكترونية Electron affinity enthalpy
– يمثل التفاعل: X + e– → X–
– الألفة الإلكترونية Electron affinity هي عملية أساسية تخص بعض الذرات وتكتسب بھا الكترون أو أكثر.
– یمكن تعریف الألفة الإلكترونية بأنھا الطاقة التي تنطلق من ذرة عندما تكتسب إلكتروناً واحداً لتصبح أیوناً سالباً.
– لصعوبة قیاس الألفة الإلكترونية بتجربة عملية فقد أمكن دراسة التفاعل المضاد لاكتساب الإلكترون وقياس حرارة الامتصاص المصاحبة له. وذلك كمقياس لألفة الذرة نحو الألكترون ΔHea وتساوي التغیر الإنثالبي المصاحب لفقد الكترون (أي شحنة واحدة سالبة).
X– → X + e–
– وكما ھو متوقع فإن الألفة الإلكترونیة تكون موجبة وذات قیمة كبیرة لذرات العناصر اللافلزیة، وھي العناصر التي تكتسب عادة الإلكترونات في التفاعلات الكیمیائیة، إضافة إلى ھذا فإن الأیونات السالبة لبعض العناصر الفلزیة النشطة تحتاج هي الأخرى الى طاقة لكي یفقد الأیون شحنته السالبة.
– ولا تستطیع الأیونات السالبة للفلزات الإحتفاظ بشحنتھا إلا في ظروف خاصة كما ھو الحال في أنابیب التفریغ.
– ویختلف الموقف في المحالیل العادیة حیث توجد عناصر ذات ألفة الكترونیة كبیرة مما یساعد على تحول الأیونات الفلزیة السالبة الى أیونات موجبة.
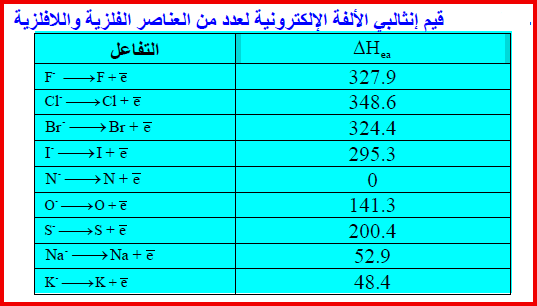
– الجدول التالي يوضح قيم إنثالبي الألفة الإلكترونیة لعدد من العناصر الفلزیة واللافلزیة ، ویلاحظ أن قیم ΔHea منخفضة لذرات الفلزات ومرتفعة لذرات اللافلزات كما يلي:
إنثالبى البلورات الأيونية lattice enthalpy
– یعتبر انثالبي التفكك ھام للحصول على طاقات للروابط التساھمیة في جزیئات (NH3, HCl, Cl2)
– أما طاقة الربط في المركبات الأیونیة فیمكننا الحصول على قیمتھا من دراسة بلورات ھذه المركبات.
– یمكن تعریف طاقة البلورة (أو طاقة بناء البلورة) ΔHxtal بأنھا التغیر في الإنثالبي الذي یصاحب اقتراب مول من أیونات غازیة ذات شحنة مضادة من مسافة بعیدة لكي تستقر في بناء البلورة الجامدة.
– قیمة التغیر في الإنثالبي مؤشراً ھاماً لقوة ارتباط الأیونات في بناء البلورة.
– من الممكن حساب طاقة البلورة لمركب أیون من مقدار الشحنة ومن حجم وترتیب الأیونات في البلورة الجامدة.
– كذلك أمكن حسابھا من طاقة بعض التفاعلات بطریقة أطلق علیھا بورن/ھاربر Born-Haber Process وقد استخدمت بنجاح منذ عام 1919م.
دورة بورن – هابر Born-Haber Cycle
– تعتمد ھذه الطریقة على قانون ھس لمعادلات الكیمیاء الحراریة.
– وتتألف من خطوات تمثل التیرات التي تحدث في دورة مغلقة بحیث تكون محصلة الطاقة في الدورة الكاملة صفراً.
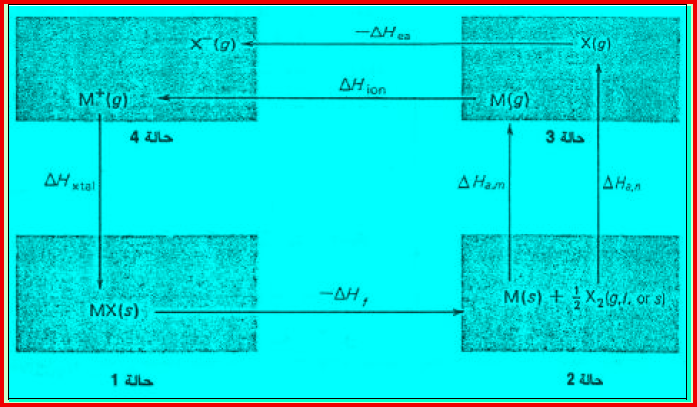
– یوضح الشكل التالي تطبیقاً لدورة بورن – ھابر على ملح كلورید الصودیوم NaCl
– الجدول التالي يوضح الأوصاف المختلفة للتعبير عن التغيرات الإنثالبية الجزئئية كما يلي:
– نلاحظ هنا أن ΔHa, m تعبر عن طاقة التسامي ΔHsub لعنصر في حالته الجامدة القياسية حيث یتسامى مباشرة الى ذرات أحادیة غازیة.
– یلاحظ أیضاً أن ΔHa, n تتساوى مع 1/2ΔHa, m لعنصر یحتوي الجزيء فیه على ذرتین في حالته القياسيى مثال: (F2 , Cl2) ولا ينطبق ذلك على كل من (I2 , Br2).
شرح دورة بورن –هابر
– لتوضیح دورة بورن – ھابر نشیر الى الشكل السابق ونبدأ بالحالة رقم 1 عن مول من مركب جامد عند درجة حرارة 25 Co وضغط جوي واحد، ثم ننتقل عبر الحالات رقم 2 ,3 ,4 ویستمر الإنتقال حتى نعود ثانیة الى الحالة رقم 1.
– نظراً إلى أن المحصلة النھائیة عند إضافة انثالبیات جمیع الحالات (أو خطوات الدورة) تكون صفراً، لذلك یمكننا التعبیر عن ذلك كما بالمعادلة التالیة:
– لقد استخدمت المعادلة السابقة لحساب انثالبي الألفة الإلكترونیة ΔHea والتي واجه العلماء صعوبة في تحدید قیمتھا عند بدایة تطبیق دورة بورن – ھابر والمعادلة المستخدمة تأخذ الشكل الآتى كما يلي:
– وقد تأكد فیما بعد الإتفاق بین قیمة ΔHea المحسوبة بدورة بورن – ھابر مع القیمة المحسوبة من تجارب قیاسھا.
أهمية دورة بورن – هابر
(1) حساب انثالبي الألفة الألكترونية ΔHea كما سبق ذكره.
(2) إیجاد طاقة البلورات وقیم حراریة أخرى لم یسبق الحصول علیھا من قبل.
– وكان من أھم تطبیقاتھا إیجاد قیم حراریة لبلورات ھالیدات العناصر القلویة مثل NaCl – KBr بدقة متناهية غير أن هذه الدقة لم تتوفر في حسابات تتعلق بالبلورات الخاصة بعناصر أخرى.
– نلخص فيمايلي طريقة حساب ΔHxtal لمركب يوديد الروبيدوم RbI:
– وقد اتفقت طاقات الربط البلوري ΔHxtal من دورة بورن – هابر مع القيم المحسوبة بطرق مختلفة.
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية