عمليات الديناميكا الحرارية Thermodynamic Processes
في هذا الموضوع سيتم مناقشة عمليات الديناميكا الحرارية Thermodynamic Processes وهي: العملیة الأیزوثیرمالیة – العملیة الأدیاباتیكیة – العملية الأیزوباركیة – العملیة الأیزوكوریة – العملیة المغلقة الدائریة وسيتم شرحها بالتفصيل.
– عندما یتحول نظام دینامیكي حراري من حالة الى أخرى، فإنه یطلق على ذلك التحول اسم عملیة (Process) وفي الحقیقة فإن العملیات التي تتم یصاحبھا تغیر في بعض خواص الأنظمة الخاضعة للتغیر، مثل الحجم والضغط ودرجة الحرارة.
– وبناءً على ھذه التغیرات یمكن تقسیم عملیات الدینامیكا الحراریة كما يلي:
محتويات الموضوع
عمليات الديناميكا الحرارية Thermodynamic Processes
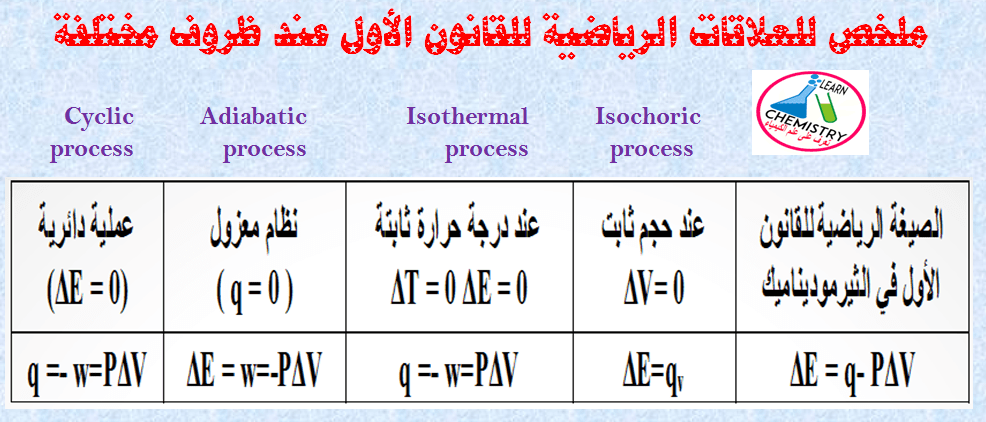
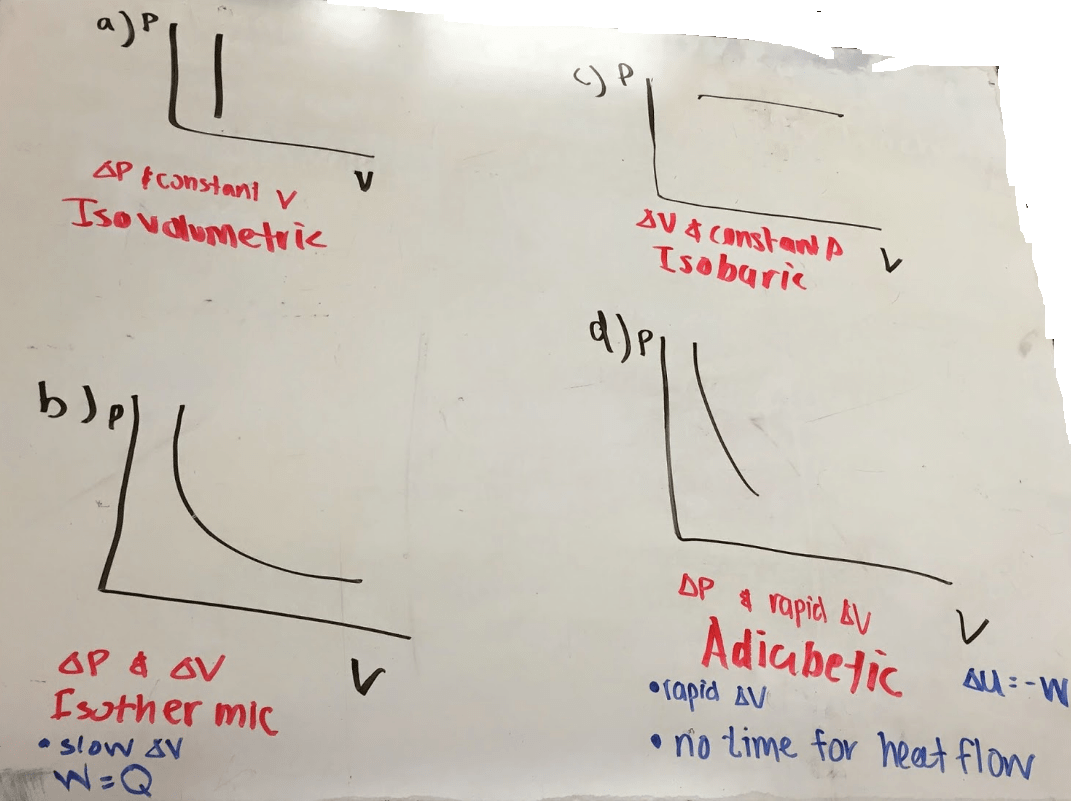
(1) العملیة الأیزوثیرمالیة Isothermal process
– وھي تلك العملیة التي تتم بینما تكون درجة الحرارة للنظام ثابتة دون تغیر.
– ویمكن تحقیق ذلك عن طریق وضع النظام في حمام مائي ذي درجة حرارة ثابتة في حالة العملیة الأیزوثیرمیة (dT =0).
(2) العملیة الأدیاباتیكیة Adiabatic process
– وھي تلك العملیة التي تتم دون انتقال للحرارة من المحيط الى النظام أو من النظام الى المحیط.
– ویمكن الوصول إلى ذلك بوضع النظام في إناء معزول (Insulated container).
– في حالة العملية الأدیاباتیكیة (dq = 0)
(3) العملية الأیزوباركیة Isobaric process
– وھي تلك العملیة التي تتم عند ثبوت الضغط.
– ومن أمثلتھا جمیع العملیات التي تتم في آنیة مفتوحة، والتي تكون معرضة للضغط الجوي.
– في حالة العملیة الأیزوباركیة (dp = 0)
(4) العملیة الأیزوكوریة Isochoric process
– وھي تلك العملیة التي تتم عند ثبوت الحجم.
– ومن أمثلتھا العملیات التي تتم دون حدوث شغل أو تمدد.
– وھكذا، فإن (dV = 0) في حالة العملیة الأیزوكوریة.
(5) العملیة المغلقة الدائریة Cyclic process
– ھي العملیة التي یمر فیھا النظام بعدد من التغیرات (العملیات)، ثم یعود أخیراً الى حالته الإبتدائیة مرة أخرى.
– وبالنسبة للعملیة المغلقة (dE = 0 ، dH = 0) (cyclic process) حیث dE ھي التغیر في الطاقة الداخلیة ، في حین dH هي التغیر في الإنثالبي.
القانون الأول للديناميكا الحرارية
– ينص القانون الأول للديناميكا الحرارية على أن: (الطاقة لا تفنى ولا تستحدث من عدم ولكن تتحول من شكل إلى آخر).
– الصيغة الرياضية للقانون:
dQ= dU + dW
حيث:
(dQ): هي كمية الحرارة التي تخرج من أو تنتقل إلى النظام.
(dU): هو التغير في الطاقة الداخلية للنظام وهي هنا دالة لدرجة الحرارة فقط (U = f (T.
(dW): هو الشغل المبذول على أو من النظام. فإذا كان النظام غازا فيكون الشغل هو حاصل ضرب الضغط p في تغير الحجم dV ويكون: dW = p . dV
– نلاحظ أن كل من dQ ، dU ، dW وحدتها وحدة طاقة (جول) ، وينطبق ذلك أيضاً على حاصل الضرب p.dV فيمكن إثبات أن وحدته هي الجول.
– الجدول التالي يوضح ملخص للعلاقات الرياضية للقانون الأول لعمليات الديناميكا الحرارية عند ظروف مختلفة كما يلي:
عمليات الديناميكا الحرارية: العمليات العكسية وغير العكسية
العملية العكسية Reversible process
– هي العملیة التي تتم ببطء متناهي في الصغر، والتي یمكن عكس اتجاھھا عند أي لحظة، بتغییر متناهى في الصغر في حالة النظام.
– أو ھي العملیة التي یمكن عكسھا عند الطلب بإحداث تغیرات متناھیة في الصغر في درجة الحرارة أو الضغط أو أیة متغیرات أخرى.
العملیة غیر العكسیة Irreversible process
– هي تلك العملیة التي تمرمن الحالة الإبتدائیة الى الحالة النھائیة في خطوة واحدة، ولا یمكن أن تسیر في الاتجاه العكسي.
– أو ھي العملیة التي لا یمكن عكسھا عند الطلب بإحداث تغیرات متناھیة في الصغر في أي من متغیرات الحالة للنظام.