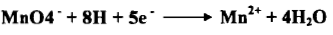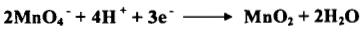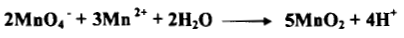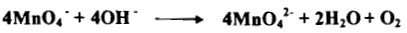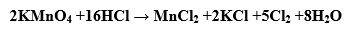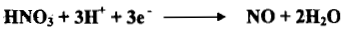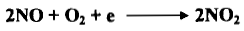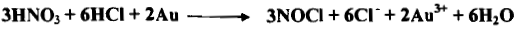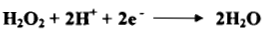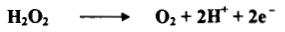العوامل المؤكسدة Oxidizing agents
فى هذا الموضوع سوف نستعرض أهم العوامل المؤكسدة المستخدمة فى تفاعلات الأكسدة والأختزال Common oxidizing agents used in Redox reactions وهي كما يلي:
(1) برمنجنات البوتاسيوم Potassium permanganate
(2) ثاني كرومات البوتاسيوم Potassium Dichromate
(3) حمض النيتريك Nitric acid
(4) الهالوجينات Halogens I2, Br2, Cl2
(5) الماء الملكي Aqua regia
(6) فوق أكسيد الهيدروجين H2O2
وسيتم دراسة كلاً تلك العوامل المؤكسدة السابقة بالتفصيل:
محتويات الموضوع
(1) برمنجنات البوتاسيوم Potassium permanganate
– برمنجات البوتاسيوم من أهم العوامل المؤكسدة فى معايرات الأكسدة والأختزال.
– هي مادة صلبة تعطي محلولاً مائياً بنفسجياً يميز هذه المادة.
– كما تعتبر برمنجنات البوتاسيوم عامل مؤكسد قوي تعمل على وفق الـ pH للوسط التفاعلي.
– تعتبر دليل ذاتي في معايرات الأكسدة والأختزال في المحاليل التي تركيزها أكبر من 0.01 N
– لا تعتبر مادة قياسية أولية وذلك للأسباب الآتية كما يلي:
(أ) برمنجنات البوتاسيوم الصلبة تحتوي على القليل من ثاني أكسيد المنجنيز الذي يسبب عدم ثبات المحاليل.
(ب) تتأثر البرمنجنات بالضوء والحرارة.
طرق الأكسدة بواسطة برمنجنات البوتاسيوم
(أ) في الوسط الحامضي
– تعتبر برمنجنات البوتاسيوم عامل مؤكسد قوي حيث تختزل بواسطة 5 إلكترونات كما يلي:
– إذا يتغير عدد تأكسد المنجنيز من +7 إلى +2 وتتحول من اللون البنفسجي إلى عديمة اللون كما هو مبين بالمعادلة السابقة.
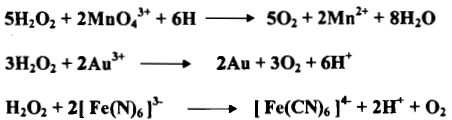
– هذه بعض التفاعلات المهمة التي تنجز بواسطة أيونات البرمنجنات في وسط حمضي كما يلي:
(ب) في الوسط المتعادل أو القاعدي الضعيف
– في وسط متعادل أو قاعدي ضعيف تعتبر برمنجنات البوتاسيوم عامل مؤكسد ضعيف حيث تختزل البرمنجنات إلى ثاني أكسيد المنجنيز إذ يتغير عدد التأكسد للمنجنيز من +7 إلى +4 وتتحول من اللون البنفسجي إلى اللون الأسود.
وكمثال على هذا تأكسد المنجنيز الثنائي:
(جـ) في الوسط القاعدي القوى
– في وسط قاعدي قوى (pH=13) أو أكثر تعتبر برمنجنات البوتاسيوم عامل مؤكسد ضعيف جداً حيث تختزل البرمنجنات إلى أيون البرمنجنات بفقدان إلكترون واحد كما يلي:
– إذ يكون عدد التأكسد للمنجنيز +6 وتظهر البرمنجنات لوناً اخضراً مميزاً. فعندما تسخن البرمنجنات مع القلويات يحدث التفاعل الاختزالي وينطلق الأكسجين:
– لوجود الأسباب من (4) إلى (7) يستخدم حمض الكبريتيك في تفاعلات الأكسدة والاختزال ببرمنجنات البوتاسيوم في الوسط الحمضي ولا يستخدم حمض الهيدروكلوريك.
عيوب الأكسدة باستخدام برمنجنات البوتاسيوم
– لمحاليل البرمنجنات عيوب عديدة منها العيوب الآتية كما يلي:
(1) تؤكسد أيون الكلوريد (–Cl) وبالتالي لا نستطيع استخدام حمض HCl كوسط حمضي كما يلي:
(2) تؤكسد الماء وتحرر غاز الأكسجين وبالتالي فان محاليلها غير ثابتة.
(3) تتأثر بالضوء ولهذا تحفظ في زجاجات بنية بعيدا عن الضوء.
تطبيقات المعايرات بواسطة برمنجنات البوتاسيوم
تستخدم برمنجنات البوتاسيوم في تقدير الكثير من المواد ومن أهم هذه التطبيقات كما يلي:
(أ) تقدير الحديد في خاماته
– تستخدم برمنجنات البوتاسيوم لتقدير الحديد الثنائي لأكسدته بواسطة برمنجنات البوتاسيوم إلى الحديد الثلاثي ويتم إتباع الخطوات الآتية كما يلي:
– إذابة العينة باستخدام حمض الهيدروكلوريك.
– اختزال الحديد الثلاثي في العينة إلى الحديد الثنائي قبل المعايرة باستخدام كلوريد القصديروز SnCl2 ويجب التخلص من كلوريد القصديروز الزائد لتفاعله مع البرمنجنات وذلك بإضافة كلوريد الزئبقيك الذي لا يتفاعل مع البرمنجنات.
– عند معايرة الحديد في وجود حمض الهيدروكلوريك الذي يستخدم لإذابة العينة فيجب إستخدام كاشف زمرمان الذي يتكون من المركبات الآتية كما يلي:
- كبريتات المنجنيز MnSO4 ويستخدم لحماية الكلوريد من الأكسدة
- حمض الفوسفوريك H3PO4 ويستخدم لتحويل الحديد الثلاثي إلى مركب عديم اللون.
- حمض الكبريتيك اللازم لمعايرات برمنجنات البوتاسيوم في الوسط الحامضي
(ب) تقدير الكالسيوم
– يقدر الكالسيوم بطريقة غير مباشرة حيث يرسب الكالسيوم على هيئة أوكسالات الكالسيوم التي عند إذابتها في حمض الكبريتيك يتكون حمض الأكساليك الذي يعاير بواسطة برمنجنات البوتاسيوم.
(2) ثاني كرومات البوتاسيوم Potassium Dichromate
– ثاني كرومات البوتاسيوم هي مادة حمراء برتقالية في حالتها الصلبة وتنتج محلولاً مائياً برتقالياً.
– تعتبر ثاني كرومات البوتاسيوم عامل مؤكسد قوي وإن كان أقل من قوة برمنجنات البوتاسيوم
– علاوة على ذلك تعتبر ثاني كرومات البوتاسيوم مادة قياسية أولية.
– كما أن محاليل ثاني كرومات البوتاسيوم محاليل ثابتة لفترة من الزمن.
– لا تتفاعل ثاني كرومات البوتاسيوم مع حمض الهيدروكلوريك.
– لا تستخدم ثاني كرومات البوتاسيوم كدليل ذاتي لأن لونها يتغير من البرتقالي إلى الأخضر.
– للأسباب أعلاه من (2) إلى (6) يفضل الأكسدة بواسطة ثاني كرومات البوتاسيوم بدلاً من برمنجنات البوتاسيوم.
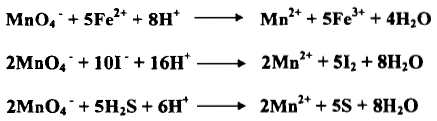
– تختزل ايونات الدايكرومات في المحلول الحامضى إلى الكروميوم الثلاثي كما في المعادلات الآتية:

تطبيقات المعايرات بواسطة ثاني كرومات البوتاسيوم
(أ) تقدير الحديد في خاماته
يتم تقدير الحديد في خاماته بإتباع الخطوات الآتية كما يلي:
(1) إذابة العينة المحتوية على الحديد في حمض الهيدروكلوريك.
(2) اختزال الحديد الثلاثي إلى الحديد الثنائي.
(3) يعاير المحلول المحتوي على الحديد الثنائي بواسطة ثاني كرومات البوتاسيوم مع إستخدام دليل ثنائي فينيل أمين أو أحد مشتقاته.
(ب) تقدير اليورانيوم
– يتم أكسدة اليورانيوم من الحالة الرباعية إلى الحالة السداسية بواسطة الحديد الثلاثي الذي يختزل ويعطي الحديد الثنائي الذي يعاير بواسطة ثاني كرومات البوتاسيوم.
(جـ) تقدير الصوديوم
– يرسب الصوديوم على هيئة خلات اليورانيوم والزنك (UO2)3Na Zn(C2H3O2)9 ثم يختزل اليورانيوم السداسي إلى اليورانيوم الرباعي الذي يعاير كما سبق الإيضاح.
(د) تقدير المواد المؤكسدة
– ويتم ذلك بإضافة كمية زائدة من الحديد الثنائي ويعاير الفائض (معايرة مرجعية) بواسطة ثاني كرومات البوتاسيوم.
(3) حمض النيتريك Nitric acid
– -حمض النيتريك يعتبر من أهم العوامل المؤكسدة فى معايرات الأكسدة والأختزال.
– يعتمد التأثير التأكسدي لحمض النيتريك على قوة تركيزه ودرجة حرارة المحلول وعادة يتكون أكسيد النيتروجين في عملية اكتساب ثلاثة الكترونات كما يلي:
– إن غاز NO عديم اللون ولكنه يتفاعل مباشرة مع أكسجين الهواء الجوي فيتكون غاز ثاني أكسيد النيتروجين كما يلي:
– يمكن سكب حمض النيتريك (مزيج 1:1 حمض النيتريك المركز والماء) على برادة الحديد مع تسخين الخليط، فنستطيع أن نرى الحديد يعطى غاز عديم اللون كما يلي:
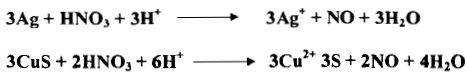
– يستعمل حمض النيتريك المركز أو نصف المركز غالباً لإذابة الفلزات والراسب حسب التفاعلات الأتية كما يلي:
– نظراً لأن حمض النيتريك تحت الظروف التي تجري فيها هذه التفاعلات لا يكون متفككاً كلياً نستعمل الصيغة HNO3 في المعادلات المذكورة آنفاً.
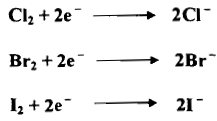
(4) الهالوجينات Halogens I2, Br2, Cl2
– يعتمد فعل الهالوجينات على تحول جزيئاتها المتعادلة بطريقة كهربائية إلى أيوناتها يتقبلها للإلكترونات كما يلي:
– تقل القدرة التأكسدية للهالوجينات بزيادة الكتلة الذرية النسبية لها فاليود مؤكسد معتدل في حين يعمل أيون اليود غالباً بوصفه مختزلاً.
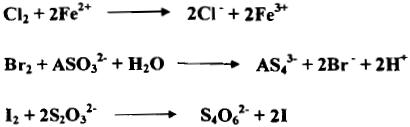
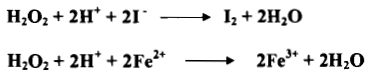
– وفيما يأتي عدداً من التفاعلات التي تستعمل في التحليل كما يلي:
(5) الماء الملكي Aqua regia
– الماء الملكي مزيج من ثلاثة حجوم من حمض الهيدروكلوريك المركز وحجم واحد من حمض النيتريك المركز.
– الماء الملكي من العوامل المؤكسدة القوية القادرة على أكسدة الفلزات النبيلة وإذابتها Noble Metals كالذهب والبلاتين.
– وتأثيره على أساس تكوين الكلور كما في المعادلة المبسطة الآتية كما يلي:
– وفي الحقيقة تتكون نواتج أكثر في إثناء العملية فمثلاً يكون كلوريد النتروزيل ويمكن الكشف عنه بسهولة.
– يمكن التعبير عن انحلال الذهب بواسطة الماء الملكي بالمعادلة الآتية كما يلي:
(6) فوق أكسيد الهيدروجين H2O2
(1) يعمل فوق أكسيد الهيدروجين بوصفه عاملاً مؤكسداً وعاملاً مختزلاً:
- عاملاً مؤكسداً: يقوم على أساس اكتساب إلكترونين في محيط حامضي كما توضحه المعادلة الآتية كما يلي:
- عاملاً مختزلاً: يقوم على أساس إطلاق إلكترونين وغاز الأكسجين كما توضحه المعادلة الآتية كما يلي:
– أن عمل فوق أكسيد الهيدروجين التأكسدي – الاختزالي يعتمد نسبياً على القوة التأكسدية النسبية أو القوة الاختزالية النسبية للمواد التي تتفاعل معه وعلى الأس الهيدروجيني pH للمحلول مثلاً مع فوق أكسيد الهيدروجين في محيط حمضي.
– يستطيع H2O2 أن يكون مؤكسداً في وسط قاعدي أيضاً فمثلاً المحلول القاعدي المحتوي على كروميوم ثلاثي يمكن أن يتأكسد بواسطة فوق أكسيد الهيدروجين إلى الكروم الرباعي.
– يمكن إنجاز الاختزال بواسطة فوق أكسيد الهيدروجين في محيط حمضي او محيط قاعدي كما يلي:
المراجع:
- كتاب أسس الكيمياء التحليلية (التحليل الوصفي والكمي والآلي) / محمد مجدي عبد الله واصل جامعة الأزهر الشريف / دار الفجر للنشر والتوزيع / القاهرة
- محاضرات الكيمياء التحليلية (التحليل الحجمى والوزني) / خيرية محمد عبدالله الأحمري /(1430 – 1429 هـ ) / جامعة الملك عبد العزيز- المملكة العربية السعودية