الكيمياء العامة
تسمية المركبات غير العضوية Nomenclature of inorganic compounds

الصيغة
الكيميائية Chemical
formula
الكيميائية Chemical
formula
تعبر الصيغة
الكيميائية عن العديد من صفات المركب، فهي تختصر الكثير من المعلومات بصيغة رمزية
وهي تعلمنا قراءة اسم المركب (NaCl) يحوي الصوديوم والكلور ونبدأ قراءة الاسم من
اليمين إلى اليسار فنقول كلوريد الصوديوم Sodium Hydroxide ، ونترات الفضة (AgNO3) وتخبرنا الصيغة الكيميائية لمركب ما عن
المعلومات الآتية:
الكيميائية عن العديد من صفات المركب، فهي تختصر الكثير من المعلومات بصيغة رمزية
وهي تعلمنا قراءة اسم المركب (NaCl) يحوي الصوديوم والكلور ونبدأ قراءة الاسم من
اليمين إلى اليسار فنقول كلوريد الصوديوم Sodium Hydroxide ، ونترات الفضة (AgNO3) وتخبرنا الصيغة الكيميائية لمركب ما عن
المعلومات الآتية:
(1) تحدد نسبة
اتحاد العناصر التي تكون المركب مثال: H2SO4 , O2 , H2O
, CHCl3
اتحاد العناصر التي تكون المركب مثال: H2SO4 , O2 , H2O
, CHCl3
(2) توضح عدد
المجموعات مثلاً SO4– – , NH2 المشاركة في المركب مثال:
Al2(SO4)3
، CO(NH2)2 .
المجموعات مثلاً SO4– – , NH2 المشاركة في المركب مثال:
Al2(SO4)3
، CO(NH2)2 .
(3) توضح عدد
جزئيات الماء المرتبطة بالمركب مثال: CuSO4.5H2O
جزئيات الماء المرتبطة بالمركب مثال: CuSO4.5H2O
(4) تحدد إذا
كانت المادة حمضية أم قاعدية : فالمواد الحمضية هي التي تحوي بروتون H+ مثل: HCl , H2SO4 , H2CO3 والمواد القاعدية هي
تلك التي تحوي مجموعات الهيدروكسيل OH– مثل: NaOH , Ca(OH)2, Al(OH)3 ، كما تبين فيما إذا كان حمضاً من حموض لويس أو قاعدة لويس.
كانت المادة حمضية أم قاعدية : فالمواد الحمضية هي التي تحوي بروتون H+ مثل: HCl , H2SO4 , H2CO3 والمواد القاعدية هي
تلك التي تحوي مجموعات الهيدروكسيل OH– مثل: NaOH , Ca(OH)2, Al(OH)3 ، كما تبين فيما إذا كان حمضاً من حموض لويس أو قاعدة لويس.
التسمية
الكيميائية Chemical Nomenclature
الكيميائية Chemical Nomenclature
لكل مادة أسم يفرقها عن بقية المواد الأخرى ، وبالرجوع للكتب
العلمية المرجعية مثل دليل الكيمياء والفيزياء فسوف نجد عدداً هائلاً من المركبات
الكيميائية مدون بها وفي الأيام الأولي للعلوم اختيرت الأسماء لأسباب مختلفة فقد
عرف الماء جيداً منذ الأقدم بهذا الاسم حتى قبل معرفته كمركب كيميائي يتكون من الهيدروجين
والأكسجين وبتطور علم الكيمياء أصبح من الضروري تطوير نظام التسمية لكي تعطي أسماء
واضحة للمواد المختلفة التي يزيد ويتضخم عددها يوماً بعد يوم .
العلمية المرجعية مثل دليل الكيمياء والفيزياء فسوف نجد عدداً هائلاً من المركبات
الكيميائية مدون بها وفي الأيام الأولي للعلوم اختيرت الأسماء لأسباب مختلفة فقد
عرف الماء جيداً منذ الأقدم بهذا الاسم حتى قبل معرفته كمركب كيميائي يتكون من الهيدروجين
والأكسجين وبتطور علم الكيمياء أصبح من الضروري تطوير نظام التسمية لكي تعطي أسماء
واضحة للمواد المختلفة التي يزيد ويتضخم عددها يوماً بعد يوم .
أما اليوم فالقسم الغالب للمواد المعروفة لها أسماء منهجية تبين
ما بها من عناصر تدخل في تركيبها، ومازالت بعض المواد محتفظة بأسمائها غير
المنهجية مثل الماء والنشادر ، وسنقدم تسمية منتظمة للمواد غير العضوية.
ما بها من عناصر تدخل في تركيبها، ومازالت بعض المواد محتفظة بأسمائها غير
المنهجية مثل الماء والنشادر ، وسنقدم تسمية منتظمة للمواد غير العضوية.
(1) المركبات
الثنائية Binary
Compound
(1)
وهي المركبات المكونة من عنصرين فقط ويسمى المركب بداية باسم الفلز (الأيون
الموجب) ثم اللافلز (الأيون السالب) مذيلاً بالنهاية (يـد) بالعربية ، ide)) باللغة الانجليزية مثل ذلك:
وهي المركبات المكونة من عنصرين فقط ويسمى المركب بداية باسم الفلز (الأيون
الموجب) ثم اللافلز (الأيون السالب) مذيلاً بالنهاية (يـد) بالعربية ، ide)) باللغة الانجليزية مثل ذلك:

(2) إذا كان العنصر فلزاً وله أكثر من تكافؤ مثل النحاس Cu+2
, Cu+ أو الحديد Fe+2
, Fe+3 أو القصدير Sn+4
, Sn+2 نبدأ اسم
المركب بهذا الفلز ولتكافؤه الأدنى يذيل اسم الفلز بالنهاية (وز) بالعربية ، (ous) بالانجليزية أما لتكافؤه الأعلى نذيله
بالنهاية (يك) بالعربية، (ic) بالانجليزية.وهذه
التسمية هو نظام قديم جداً وقد وضعه العالم الألماني Alfred stock نظاماً سمى باسم نظام ستوك
Stock system وقد بين حالة
التأكسد للفلز وتشمل وضع رقم روماني مساو لعدد التأكسد للفلز في أقواس تلي الاسم
الانجليزي المنتظم للعنصر كما هو موضح بالأمثلة التالية:
, Cu+ أو الحديد Fe+2
, Fe+3 أو القصدير Sn+4
, Sn+2 نبدأ اسم
المركب بهذا الفلز ولتكافؤه الأدنى يذيل اسم الفلز بالنهاية (وز) بالعربية ، (ous) بالانجليزية أما لتكافؤه الأعلى نذيله
بالنهاية (يك) بالعربية، (ic) بالانجليزية.وهذه
التسمية هو نظام قديم جداً وقد وضعه العالم الألماني Alfred stock نظاماً سمى باسم نظام ستوك
Stock system وقد بين حالة
التأكسد للفلز وتشمل وضع رقم روماني مساو لعدد التأكسد للفلز في أقواس تلي الاسم
الانجليزي المنتظم للعنصر كما هو موضح بالأمثلة التالية:

وعلى الرغم من أن نظام ستوك هو المفضل هذه الأيام إلا أنه من
الضروري معرفة النظام القديم كذلك
الضروري معرفة النظام القديم كذلك
(3) إذا كان المركب يحتوي على عنصرين لافلزين يفضل نظام ثالث
تكون فيه أعداد كل ذرة في الجزئ محددة ببادئة إغريقية ونستعمل التعبيرات(1) – mono, (2) – di, (3) – tri, (4) – tetra, (5) –
penta وهكذا
تكون فيه أعداد كل ذرة في الجزئ محددة ببادئة إغريقية ونستعمل التعبيرات(1) – mono, (2) – di, (3) – tri, (4) – tetra, (5) –
penta وهكذا

(2) مركبات تحتوي
على أيونات متعددة الذرات Polyatomic Compounds
لتسمية المركبات التي تحتوي عنصراً موجباً أو كاتبون Cation مع شق سالباً أو أنيون Anion
فإننا نبدأ بتسمية الكاتيون (الأيون الموجب) ثم بالشق السالب ملاحظين تكافؤ الشقين
(الموجب ، السالب) ويفضل نظام ستوك عندما يكون للفلز أكثر من حالة تأكسد واحدة،
ومن الأمثلة التي توضح ذلك:
فإننا نبدأ بتسمية الكاتيون (الأيون الموجب) ثم بالشق السالب ملاحظين تكافؤ الشقين
(الموجب ، السالب) ويفضل نظام ستوك عندما يكون للفلز أكثر من حالة تأكسد واحدة،
ومن الأمثلة التي توضح ذلك:

(3)
تسمية الأحماض والقواعد Nomenclature
of acids and bases
من المواد المهمة في المركبات الكيميائية ما يسمى بالأحماض
والقواعد، الأحماض هي مواد تطلق أيونات H+ ، عندما تذوب في الماء وتتكون من شقين شق سالب (المجموعات الذرية)
والشق الموجب الهيدروجين (ويعرف بالهيدروجين البدول) حيث عند تفاعل حمض مع قاعدة
تستبدل الهيدروجين بفلز القاعدة أو مجموعة الأمونيوم لتكوين الملح.
والقواعد، الأحماض هي مواد تطلق أيونات H+ ، عندما تذوب في الماء وتتكون من شقين شق سالب (المجموعات الذرية)
والشق الموجب الهيدروجين (ويعرف بالهيدروجين البدول) حيث عند تفاعل حمض مع قاعدة
تستبدل الهيدروجين بفلز القاعدة أو مجموعة الأمونيوم لتكوين الملح.
القواعد هي مواد تطلق أيونات OH– عندما تذوب في الماء وتتكون من شقين ، شق موجب (فلز أو مجموعة الأمونيوم)
وشق سالب (أكسجين أو مجموعة الهيدروكسيد) حيث أن معظم المركبات هي أملاح ناتجة من
تفاعل حمض أو قاعدة
وشق سالب (أكسجين أو مجموعة الهيدروكسيد) حيث أن معظم المركبات هي أملاح ناتجة من
تفاعل حمض أو قاعدة
أولاً: تسمية الأحماض وأملاحها
** لنبدأ أولاً بتسمية الأحماض :
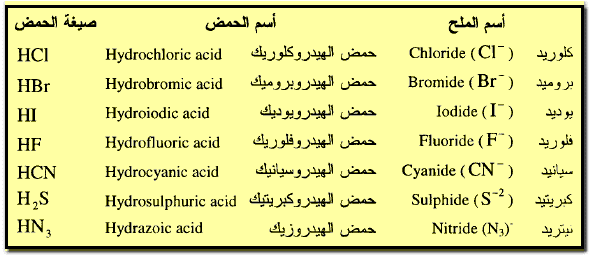
** وكذلك الأحماض الأكسجينية التى
تحتوي على أقل عدد من ذرات الأكسجين بالنهاية العربية (وز) والانجليزية (ous)
بينما الأكثر احتواء على ذرات الأكسجين بالنهاية العربية (يك) والانجليزية (ic)
تحتوي على أقل عدد من ذرات الأكسجين بالنهاية العربية (وز) والانجليزية (ous)
بينما الأكثر احتواء على ذرات الأكسجين بالنهاية العربية (يك) والانجليزية (ic)
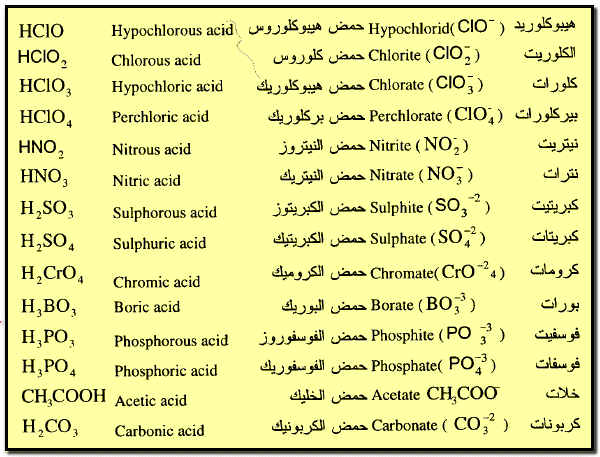
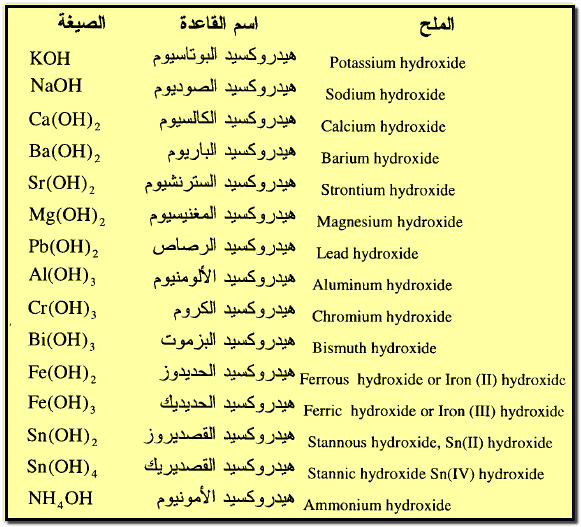
ثانياً: تسمية القواعد
تمارين
محلولة
مثال 1: اكتب الصيغة الكيميائية للمركبات التالية:
كلوريد الالومنيوم – نترات البوتاسيوم – خلات الرصاص –
الأسيتالدهيد – كربونات الزنك – كربونات الصوديوم – بيكربونات الصوديوم – حمض
الفسفور
الأسيتالدهيد – كربونات الزنك – كربونات الصوديوم – بيكربونات الصوديوم – حمض
الفسفور
الحل:

مثال2: اكتب اسم المركبات التالية :
KOH – CO2 –
Fe(NO3)3 – NaNO3 – Fe(CO3)3
– Na3PO4 – (NH4)2SO4 –
CrCl3
Fe(NO3)3 – NaNO3 – Fe(CO3)3
– Na3PO4 – (NH4)2SO4 –
CrCl3
الحل:

المراجع
– مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي الدين البكوش – نوري بسيبسو – ياسر حورية- نبيل شيخ قروش، الطبعة الثانية (2003م) / شركة الجا للنشر العلمي – طرابلس.